
生物物理研究所柯莎研究组揭示小分子化合物PES通过巯基共价修饰抑制Hsp70的功能
2021年 1月1日,《生物化学杂志》(JBC)发表了中科院生物物理研究所柯莎(Sarah Perrett)研究组的研究论文,题为"PES inhibits human inducible Hsp70 by covalent targeting of cysteine residues in the substrate binding domain"。该研究工作是柯莎研究组对Hsp70结构与功能的关系及Hsp70半胱氨酸巯基反应活性长期研究获得的重要成果。研究发现人源应激型Hsp70(hHsp70)的C末端底物结合域的α螺旋盖子(SBDα)上的两个半胱氨酸Cys574和Cys603的巯基能与小分子化合物PES(2-phenylethynesulfonamide or pifithrin-μ)的炔基发生Michael不对称加成反应,导致hHsp70发生类似于谷胱甘肽化修饰的结构和功能的变化。研究还发现,PES与hHsp70的反应活性与hHsp70的构象相关,因此PES还可以作为探针反映hHsp70的结构域之间相互作用的变化。此前他们的研究工作已经发现hHsp70的这两个Cys发生谷胱甘肽化修饰,可导致SBDα去折叠并作为假底物封闭底物结合结构域,从而关闭其分子伴侣功能。本研究通过发现PES对SBDα上的Cys的共价修饰抑制了hHsp70的分子伴侣活性,验证了针对这两个Cys开发hHsp70的共价抑制剂这一全新思路的可行性。
由于Hsp70对于多种细胞生理活动的重要性,特别是对于提高肿瘤细胞耐受恶劣细胞环境的贡献,Hsp70已经被确认为很多疾病,特别是癌症治疗的药物靶标。虽然已发展出来的Hsp70的抑制剂很多,但是目前仍然没有能通过三期临床实验的靶向Hsp70的药物。共价抑制剂往往具有更低的反应可逆性,而能发挥更长效的作用,在蛋白抑制剂开发方面具有独特的优势。在PES的前期研究中,虽然人们经常将它用作抗癌治疗研究的单独或联合用药的研究对象,但是并不清楚它杀伤肿瘤细胞的详细机制,该研究发现PES能和蛋白上的巯基发生共价反应,将有助于对PES在细胞内作用靶标的鉴定以及揭示PES对肿瘤细胞高毒性而对正常细胞低毒性的详细机制,从而进一步推动PES在癌症临床治疗研究中的应用。
该研究主要由柯莎课题组的已毕业博士生杨杰(第一作者)、张红副研究员和宫维斌副研究员完成相关实验。吴思副研究员为Hsp70和PES的反应动力学分析提供了支持。柯莎研究员和张红副研究员为共同通讯作者。该研究得到了科技部国家重点研发计划、国家自然科学基金委项目资助。
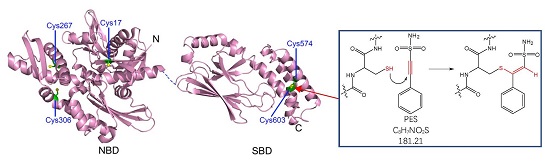
图解:人源应激型Hsp70(hHsp70)的C末端底物结合域的α螺旋盖子(SBDα)上的两个半胱氨酸Cys574和Cys603的巯基与小分子化合物PES(2-phenylethynesulfonamide or pifithrin-μ)中的炔基发生Michael不对称加成反应
文章链接:https://www.jbc.org/article/S0021-9258(20)00206-9/fulltext
(供稿:柯莎研究组)
附件下载: