
内质网蛋白P5A ATPase/CATP-8通过清除异位蛋白维持内质网"身份"
膜蛋白被正确地定位到相应的细胞器上对于维持细胞器特异"身份"和生理功能非常重要。膜蛋白的正确定位不仅依赖于精确的蛋白分选通路,也需要细胞器上相应的机制清除错误定位的蛋白。比如在线粒体外膜的AAA-ATPase Msp1可以把错误定位到线粒体外膜的蛋白清除。但是在内质网(ER)上是什么机制帮助移除错误定位的膜蛋白目前知之甚少。
针对这一问题,中国科学院生物物理研究所王香明博士和斯坦福大学沈康教授合作,2020年11月10日在Cell Reports杂志发表了题为"An Endoplasmic Reticulum ATPase Safeguards Endoplasmic Reticulum Identity by Removing Ectopically Localized Mitochondrial Proteins"的研究论文。该工作发现P5A ATPase/CATP-8可以将错误定位到ER上的线粒体信号锚定蛋白(signal anchored,SA)和尾部锚定蛋白(tail anchored,TA)移除,维持ER特异"身份"。
研究人员以线粒体SA/TA蛋白为研究对象,在线虫中进行大规模筛选,发现catp-8突变体导致线粒体SA/TA蛋白错误定位至ER,而线粒体表面的两次跨膜蛋白不会被影响。荧光定位实验发现CATP-8特异定位在ER上,暗示其在ER上发挥功能。有意思是,通过光转换和热激诱导表达实验,研究人员发现CATP-8可以将已经错误定位到ER上的线粒体蛋白移除,并且该过程不依赖于ERAD通路。为了研究CATP-8移除ER错误定位蛋白对维持ER特异"身份"的重要性,研究人员发现线粒体外膜蛋白FIS-1和MFF-2在catp-8突变体中错误定位至ER,导致线粒体分裂因子DRP-1被错误招募到ER上,从而引起ER断裂。同时,研究人员还发现CATP-8通过调控树突受体蛋白DMA-1水平影响线虫PVD神经元树突形态发育。这暗示出CATP-8不仅通过移除错误定位到ER的线粒体蛋白以维持正确的ER形态,同时也对维持ER正常生理功能很重要。该研究报道了ER蛋白P5A ATPase/CATP-8行使监察机制将错误定位在ER上的蛋白移除,以及其对维持ER正确的形态和功能的重要性。
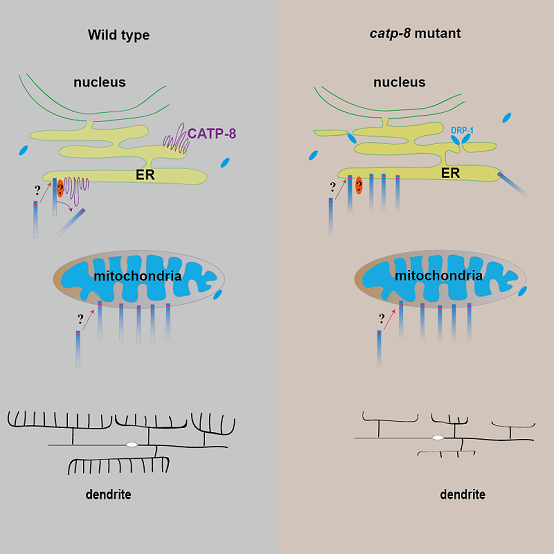
内质网P5A ATPase/CATP-8 作为监察机制维持内质网“身份”
生物大分子重点实验室徐涛组王香明副研究员以及斯坦福大学沈康教授为本文的通讯作者;博士生秦晴为本文的第一作者;浙江大学邹炜研究员和博士生赵婷为该课题做出了重要贡献。该研究受到国家重点研发计划、中国科学院战略性先导科技专项(B类)、北京脑科学专项、国家自然基金等项目的资助。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(20)31352-8
(供稿:徐涛研究组)
附件下载: