
纳米酶前药催化治疗肿瘤新策略
近日,《Nano Today》在线发表了中国科学院生物物理研究所/中国科学院纳米酶工程实验室阎锡蕴院士团队的研究论文" A Metal-Free Nanozyme-Activated Prodrug Strategy for Targeted Tumor Catalytic Therapy "。该工作首次提出了纳米酶前药系统用于肿瘤催化治疗的新策略,为肿瘤治疗提供了新思路,进一步拓展了纳米酶的生物医学应用。
酶学疗法一直是一个非常吸引人的疾病治疗策略,因为酶催化具有高效性和特异性。比如酶激活前药治疗策略,因其高选择性和低毒性,是一种前景广阔的抗癌策略,特别是辣根过氧化物酶(HRP)和前药吲哚-3-乙酸(IAA)已被证明是一组有效的酶前药体系。该系统在体内应用时,HRP可以通过抗体偶联或者基因递送的方式引入肿瘤细胞中。前药IAA则是系统给药后,通过自由扩散的方式到达肿瘤部位,进而与HRP发生反应释放活性成分甲基吲哚自由基,杀灭肿瘤细胞。然而该策略存在两大缺陷:首先,抗体偶联靶向面临蛋白酶降解以及HRP在肿瘤细胞外发挥作用的局限,从而限制其肿瘤杀伤效果;同时,基因递送方式中,有效的肿瘤靶向递送以及外源性HRP在肿瘤细胞中选择性表达存在困难,还存在转基因安全性问题。其次,由于前药IAA是通过自由扩散作用到达肿瘤部位,其在肿瘤部位富集不足,无法引发足够的催化反应杀伤肿瘤。因此,提高酶激活前药策略的治疗效果,需要酶能够高效到达肿瘤部位,同时提高前药在肿瘤部位的富集。
为解决上述问题,研究人员提出了基于纳米酶的酶激活前药策略。纳米酶是近年来发现的具有类酶催化活性的纳米材料,是新一代模拟酶。与天然酶相比,纳米酶稳定性高,不会被蛋白酶降解;同时纳米酶作为纳米材料具有多功能性,除了酶催化活性,还可以作为纳米载体装载药物或靶向分子,因此有望开发更加高效的酶催化治疗策略。目前纳米酶主要以无机纳米材料为主,其活性主要是氧化还原酶活性。目前报道的纳米酶大多数为金属氧化物(如氧化铁、氧化铜、氧化铈等)或贵金属(金、银、钯、铂等)类纳米材料,在体内应用时难以降解代谢,还有可能释放金属离子产生细胞毒性,因此存在潜在的生物相容性和安全性等问题。近几年碳纳米酶受到广泛关注,比如石墨烯、碳纳米管、碳点等,尤其是异原子掺杂有可能更好地模拟天然酶的催化活性中心结构,展现出高过氧化物酶活性;同时其主体是非金属的碳类结构,与酶蛋白分子元素相近,具有较好的生物相容性,因此,可能作为酶前药策略中理想的天然酶替代物。
研究人员基于碳纳米酶的过氧化物酶活性建立了纳米酶前药治疗肿瘤策略。首先,利用生物安全性和稳定性高的非金属元素掺杂碳纳米酶提高其过氧化物酶活性。研究人员通过理论计算模拟了一系列非金属元素掺杂的碳纳米酶的过氧化物酶活性,发现N、P双掺杂的纳米酶具有最低的反应决速步能垒,因此具有最高的酶活性。经过实验验证,N、P的协同效应使该碳纳米酶的过氧化物酶活性提高了近3倍,与理论计算预测的一致。这些结果也表明,对于碳纳米酶,除了掺杂金属外,优化非金属结构也能显著性提高纳米酶的活性。
在此基础上,研究人员构建了一种肿瘤靶向的纳米酶前药体系,其由三部分组成:N、P双掺杂的碳纳米酶,通过π-π堆叠装载的前药IAA以及表面修饰的肿瘤靶向配体叶酸。在叶酸的靶向引导下,纳米酶前药体系进入肿瘤细胞,定位于溶酶体中;肿瘤细胞溶酶体酸性环境触发纳米酶的过氧化物酶活性,有效激活前药IAA引发活性氧风暴,最终通过线粒体凋亡途径导致肿瘤细胞死亡。该纳米酶前药体系在动物实验上也展现了良好的抗肿瘤效果和生物安全性。这些结果表明用纳米酶替代天然酶用于酶激活前药治疗肿瘤是可行的,同时纳米酶作为载体能够更加高效的将前药输送到肿瘤部位,充分发挥了其酶催化和纳米载体的双重功能。综上,本研究为酶前药肿瘤治疗提供了新策略,有望成为肿瘤靶向催化治疗新方向。
该工作由中国科学院生物物理研究所、扬州大学和江西师范大学合作完成。中国科学院生物物理研究所/中国学院纳米酶工程实验室阎锡蕴院士、高利增研究员和范克龙研究员为共同通讯作者,中国科学院生物物理研究所博士生梁倩、扬州大学奚菊群副教授和江西师范大学高雪皎博士为共同第一作者。本研究得到了国家自然科学基金、国家重点研发计划、中国科学院先导专项、中国科学院青年创新促进会等项目的资助。
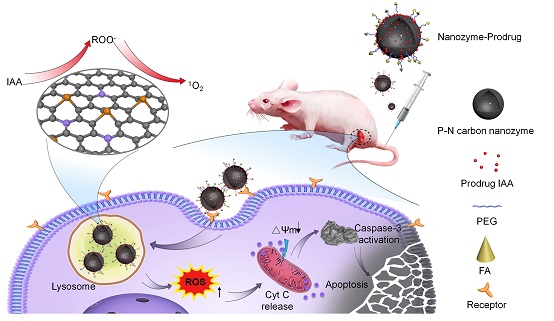
纳米酶前药催化治疗肿瘤示意图
文章链接:https://www.sciencedirect.com/science/article/pii/S1748013220301043
(供稿:范克龙研究组)
附件下载: