
许文青/梁栋材课题组揭示ALKBH1
DNA 6mA(N6-甲基腺苷)作为DNA的第二种修饰形式,是哺乳动物基因组表观遗传调控的重要组成。基因组6mA的水平在生物体内具有调节组织发育、性别比例、基因表达、X染色体失活等多种作用,阐明其调控机制是解码这一新型修饰碱基生物学功能的关键。2016年,耶鲁大学Andrew Xiao首次报道ALKBH1在真核生物中具有DNA 6mA去甲基化酶活性,而后一系列的研究表明人源ALKBH1的异常表达导致了多种发育缺陷和癌症的发生。然而,ALKBH1的生化机理和分子机制并不清楚。
2020年3月10日,《Cell Research》正式发表了生物物理所许文青/梁栋材课题组与中国农大陈忠周课题组合作的题为“Structural basis of nucleic acid recognition and 6mA demethylation by human ALKBH1”的研究论文,在ALKBH1的核酸底物识别及6mA去甲基化机制研究方面取得突破性进展。
该工作首次报道了人源ALKBH1 free状态以及ALKBH1-Mn2+-α-KG复合物的高分辨率晶体三维结构。ALKBH1区别于AlkB家族其它蛋白,具有多个新的结构特征。其独有的Flip0区域,位于活性中心的口袋附近,对于ALKBH1底物识别和发挥6mA去甲基化酶活性中起着至关重要的作用。远离活性中心且带正电荷的Flip1,在面向活性中心的一侧有大量的碱性氨基酸残基,形成一个较大的正电荷区域,这些碱性残基的突变使ALKBH1丧失了与DNA的结合能力。此外,ALKBH1结合α-KG后活性中心附近的Tyr184和Glu236向活性中心移动并通过氢键与Arg344形成稳定的三角形结构,保证了ALKBH1 执行6mA去甲基化酶的活性。此外,在ALKBH1结构中Flip1、Flip2含有很长一段Loop, 其构象变化与位于Flip2上的Tyr177、Trp179一起参与了DNA 6mA的识别和结合。在这个工作中,我们还发展了一种新颖、稳定且高通量的6mA去甲基化的体外酶促方法。通过这个方法对不同底物进行初筛,结合三维结构分析和质谱测定结果表明,ALKBH1的优先底物是凸起状或气泡状的非配对dsDNA,Bulge或Bubble;而不是ssDNA或dsDNA。这种对局部不配对特征的核酸修饰碱基去甲基化在生理学上有着重要的意义。这项研究工作为ALKBH1的底物选择机制, 催化反应机理和生理功能的探究提供了结构基础, 并为相关疾病的药物设计提供了重要依据。
中国科学院生物物理研究所许文青/梁栋材课题组闫小雪副研究员和中国农业大学陈忠周教授为本文的共同通讯作者,博士研究生田利飞和刘晏平助研为本文的共同第一作者,陈联琦、唐群和孙伟博士,以及中国农大的吴薇博士参与了该项工作的完成。上海同步辐射光源(BL19U1、BL17U1)和生物物理所科学研究平台为该研究提供了重要的技术支持。这项研究得到中国科学院战略性先导科技专项、生物大分子国家重点实验室和国家自然科学基金的资助。
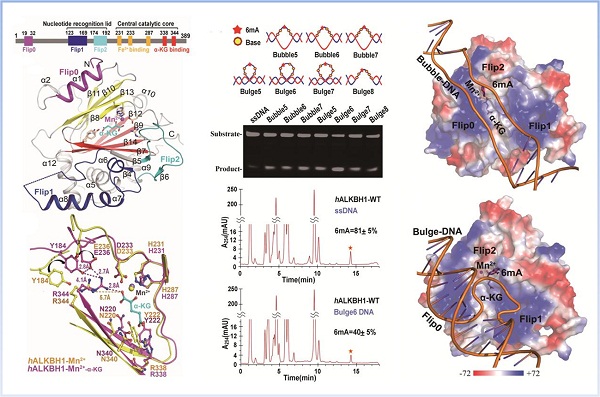
ALKBH1识别与催化Bubble/Bulge DNA 6mA去甲基化的结构基础
文章链接:https://www.nature.com/articles/s41422-019-0233-9
(供稿:文青/梁栋材研究组)
附件下载: