
蓝藻光合作用光系统I捕获
2020年2月10日,国际学术期刊《自然-植物》(Nature Plants)在线发表了题为《Structural basis for energy and electron transfer of the photosystem I–IsiA–flavodoxin supercomplex》的研究论文,该项工作是由中国科学院生物物理研究所李梅/常文瑞课题组与章新政课题组合作完成的。
光合蓝藻(Cyanobacteria)是海洋区域主要的有机物初级生产者,并具有光合效率高、生长速度快和易于进行基因改造等优点,是一种理想的基因工程宿主菌,也是光合作用研究的模式生物。蓝藻所生存的自然水生态系统营养成分、光照和温度等不断发生着变化,特别是铁缺乏的现象普遍存在,这是由于亚铁离子易被氧化成溶解度低的铁离子,从而造成铁离子在天然水环境中含量很低。而蓝藻中光系统I (PhotosystemI,PSI)及其电子受体铁氧还蛋白(Ferredoxin, Fd)都是结合有多个铁离子的蛋白,其数量在缺铁环境中会大幅减少。为了应对缺铁胁迫的生存环境,并维持高效的光合效率,蓝藻进化出一种有效的适应与调控机制,包括大量合成缺铁诱导的捕光天线膜蛋白-色素复合物IsiA及结合黄素单核苷酸的黄素氧还蛋白(Flavodoxin, Fld),18个IsiA结合在PSI的周围,增加PSI的捕光效率,同时Fld替代Fd从PSI接受电子,形成分子量超过2兆道尔顿的PSI-IsiA-Fld超级复合物。
该项工作报道了蓝藻Synechococcus sp. PCC 7942来源的PSI-IsiA和PSI-IsiA-Fld两种超级复合物的单颗粒冷冻电镜结构,分辨率分别为2.9埃和3.3埃。PSI-IsiA结构揭示了蓝藻PSI三聚体核心与18个IsiA天线蛋白之间精确的装配原理和复杂的能量传递途径,并发现了新的色素结合位点及其相关的新能量通路。PSI-IsiA-Fld结构展示了Fld蛋白与PSI结合的具体位置及相互作用细节,揭示了在缺铁胁迫状态下PSI维持其有效电子传递的结构基础。在研究过程中,由于Fld电子受体结合的灵活性,研究人员通过外源添加和交联的方式固定了电子受体,从而成功获得了稳定的PSI-IsiA-Fld复合物。该项研究结果有助于人们理解蓝藻发挥光合作用及其动态调控的分子机理,并且为在结构基础上开展蓝藻基因工程改造提供了数据。
中国科学院生物物理研究所李梅研究员和章新政研究员为该论文的共同通讯作者,李梅/常文瑞课题组的曹鹏副研究员和章新政课题组的曹端方副研究员为共同第一作者,中国科学院植物研究所的田利金研究员和生物物理研究所的柳振峰研究员也参与了该项工作。该研究工作得到了科技部重点研发计划、中国科学院B类先导专项、中国科学院前沿科学重点研究项目、国家自然科学基金的共同资助。中国科学院青岛能源所的吕雪峰课题组提供了蓝藻菌株,数据收集和样品分析等工作得到了生物物理所“生物成像中心”、生物物理所蛋白质科学研究平台等有关工作人员的大力支持和帮助。
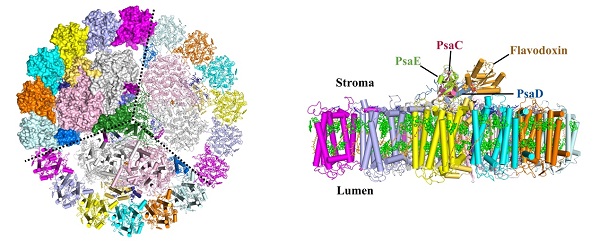
图示:
左图:从胞质侧观察PSI-IsiA超复合物的整体结构(为清楚起见去掉了胞质侧的外周亚基),虚线分开PSI三体的每个单体。右图:从膜平面方向观察PSI-IsiA-Fld超复合物的整体结构,只展示了一个PSI核心及6个IsiA蛋白,PSI核心外周亚基及Fld蛋白在图中标出。
文章链接:https://www.nature.com/articles/s41477-020-0593-7
(供稿:李梅研究组)
附件下载: