
李国红/陈萍/李伟合作团队揭示
真核细胞基因组DNA被组装形成染色质存储在细胞核中。核小体,作为染色质的基本结构单元,在基因复制与转录过程中高度动态调控。DNA/RNA聚合酶前的核小体结构要被打开,使得聚合酶能顺利通过核小体,对核小体包裹的DNA进行复制转录;而聚合酶通过后的DNA要被重新组装形成核小体,保护DNA免受损伤,并维持或继承该区域表观遗传信息。组蛋白泛素化修饰,作为一类重要的组蛋白化学修饰方式,在核小体结构的动态调控中发挥至关重要的作用。
H2A作为最早发现被泛素化修饰的组蛋白,在高等真核生物中,约有5-15%的H2A在高度保守的K119位被单泛素化修饰(ubH2A)。研究发现ubH2A大量富集在不活跃的近着丝粒区、失活的X染色体和沉默的发育基因区域。ubH2A的建立主要依赖多梳复合物(PRC)中的RING1B(E3),敲除RING1B能显著降低特点基因启动子附近的ubH2A水平,并导致ubH2A总体水平的显著下降。但是对于ubH2A建立起来后如何调控核小体仍然并不清楚。2020年2月5日,中国科学院生物物理所李国红、生物物理所客座研究员/首都医科大学陈萍与物理所李伟合作团队在JACS上在线发表了题为“Histone H2A Ubiquitination Reinforces Mechanical Stability and Asymmetry at theSingle-Nucleosome Level”文章,从单分子水平上探讨ubH2A对核小体结构调控的分子机制。
该研究工作揭示ubH2A本身可以显著增加核小体的稳定性。单分子磁镊研究发现没有泛素化修饰的核小体外圈DNA在5pN力下打开,而在ubH2A存在下需要20pN的力;自由能分析发现,核小体外圈DNA打开需要消耗自由能32kJ/mol;而H2A被泛素化修饰以后,打开核小体外圈DNA需要消耗自由能210kJ/mol。在增强核小体机械稳定性的同时,荧光共振能量转移FRET研究发现ubH2A同时显著增强核小体的盐浓度依赖稳定性。进一步研究发现核小体上的两个ubH2A没有协同作用,其中一个ubH2A分别增强一个核小体外半圈DNA稳定性;单分子原位去泛素化分析进一步证实了这一点。利用USP21去泛素化ubH2A核小体,可以恢复核小体的稳定性到未修饰水平。深入机制探讨发现ubH2A上的泛素修饰蛋白通过其位置效应,像栓子一样稳定核小体外圈DNA,阻碍DNA从核小体上剥离,达到稳定核小体的作用。该研究为后续进一步探讨H2A泛素化修饰与其它蛋白如连接组蛋白H1、PRC复合物和FACT复合物协同作用机制奠定基础。博士研究生肖雪、刘翠芳博士和硕士研究生裴迎新为本文共同第一作者,本研究获得科技部、中科院、国家自然科学基金等项目的资助。
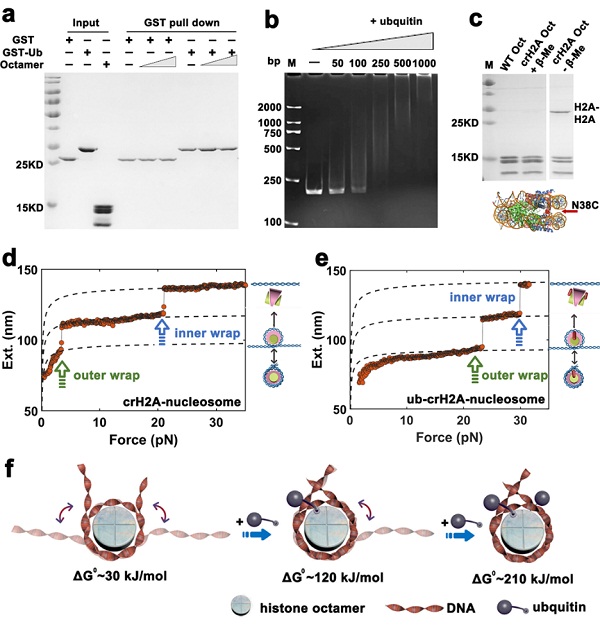
图一:组蛋白H2A泛素化修饰稳定核小体结构的分子机制
文章链接:https://pubs.acs.org/doi/10.1021/jacs.9b12448
(供稿:李国红研究组)
附件下载: