
蓝藻光合作用环式电子传递的结构基础
2020年1月30日,Nature Communications期刊以Article形式发表了中科院生物物理研究所常文瑞/李梅研究组、章新政研究组及中科院上海植物生理生态研究所米华玲研究组的合作研究成果,题为“Structural basis for electron transport mechanism of complex I-like photosynthetic NAD(P)H dehydrogenase”(DOI: 10.1038/s41467-020-14456-0)。该项工作用单颗粒冷冻电镜方法解析了来源于嗜热蓝藻T.elongatusBP-1的一种参与光合作用环式电子传递的多亚基膜蛋白复合物NDH-1L,及其结合电子供体铁氧还蛋白(ferredoxin, Fd)的三维结构。
光合生物的电子传递可分为线性电子传递和环式电子传递两种类型。线性电子传递产生NADPH和ATP,供光合作用卡尔文循环和其它细胞代谢反应所利用。但是线性电子传递过程中生成的ATP和NADPH的比例不足以满足卡尔文循环所消耗的ATP和NADPH的比例,因而在光合生物中还有环式电子传递。该过程中,电子通过质体醌(plastoquinone,PQ)在PSI和细胞色素b6f(Cytb6f)复合物之间循环,仅产生ATP而不会产生NADPH。环式电子传递具有非常重要的生理意义,它能够增加ATP/NADPH比例,从而提高卡尔文循环的效率;此外,环式电子传递还在光保护中起着重要作用,并帮助光合生物快速响应环境变化。
在蓝藻中,一种I型NAD(P)H脱氢酶复合物(NDH-1L)对于环式电子传递至关重要。研究表明,铁氧还蛋白(Fd)接受PSI传递的电子,并将之进一步传递给NDH-1L复合物,由结合在NDH-1L的PQ分子将电子转移至Cytb6f,与此同时,NDH-1L将质子从细胞质侧泵到类囊体腔侧,形成跨膜质子梯度驱动ATP生成。蓝藻的NDH-1L复合物包含19个亚基,其结构已于2019年由美国和英国的2个研究组分别报道,但是已报道的结构中都缺少一个与其功能密切相关的重要亚基NdhV,此外,PQ分子和电子供体Fd结合NDH-1L的具体位置及相互作用信息都不清楚。对NDH-1L及其结合Fd/PQ的复合物的三维结构研究将有助于揭示光合作用环式电子传递的机理。
中科院生物物理研究所和上海植物生理生态研究所的联合团队通过密切合作,利用单颗粒冷冻电镜方法,解析了来源于嗜热蓝藻T.elongatusBP-1的两个NDH-1L结构,分别结合有内源性PQ分子(NDH-PQ)和电子供体Fd蛋白(NDH-Fd),分辨率分别是3埃和3.2埃(图示a,b)。NDH-PQ结构揭示了环式电子传递链的重要组分PQ分子的结合位点;NDH-Fd结构包含NDH-1L复合物的全部19个蛋白亚基,揭示了电子供体Fd与NDH-1L复合物的相互作用细节。研究结果首次提供了完整的NDH-1L结构模型,揭示了PQ分子的结合位置,构建了从Fd到PQ的电子传递途径(图示c),并测定了NDH-1L在不同pH条件下的活性及其与Fd的亲和力。该项工作为揭示NDH-1L参与的环式电子传递和质子泵耦联机制提供了重要的分子基础。
中国科学院生物物理研究所李梅研究员、章新政研究员,以及上海植物生理生态研究所的米华玲研究员为论文的共同通讯作者。潘晓伟副研究员、曹端方副研究员、博士生谢芬和徐放为该项工作的共同第一作者。该研究工作得到了科技部重点研发计划、中国科学院B类先导专项、中国科学院前沿科学重点研究项目、国家自然科学基金和中科院青年创新促进会的共同资助。数据收集和样品分析等工作得到了生物物理所“生物成像中心”、生物物理所蛋白质科学研究平台等有关工作人员的大力支持和帮助。
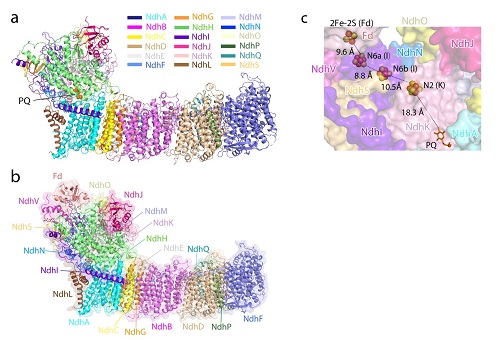
图示. NDH-PQ(a)和NDH-Fd(b)复合物三维结构及电子传递链辅因子(c)
文章链接:https://www.nature.com/articles/s41467-020-14456-0
(供稿:李梅研究组)
附件下载: