
李国红课题组和朱明昭课题组合作,
2019年12月25日,生物大分子国家重点实验室的李国红课题组与感染与免疫院重点实验室的朱明昭课题组合作,在Nature上发表了题为“H2A.Z facilitates licensing and activation of early replication origins”的论文。该研究发现组蛋白变体H2A.Z能够通过H2A.Z-SUV420H1-H4K20me2-ORC1通路帮助在染色质进行复制起始位点的选择,并进一步发现受H2A.Z调控的复制位点相比与其他的复制位点有着更高的复制信号,也更偏向在复制期早期被激活使用。
DNA复制是一个确保遗传信息精确传递的生命过程。细胞在G1期时,复制起始识别复合物(Origin Recognition Complex, ORC)识别染色质上的复制位点,进一步的招募DNA解旋酶MCM等,形成复制前体复合物(pre-Replication Complex),完成复制起始位点的认证。而当细胞进入复制期S期时,被认证的复制起始位点被选择性的激活使用。在真核生物中,复杂的染色质结构上存在多个复制起始位点。真核生物DNA复制起始位点的选择受DNA序列和表观遗传因素共同调控。目前,表观遗传因素对染色质上DNA复制起始位点的选择机制仍然很不清楚。
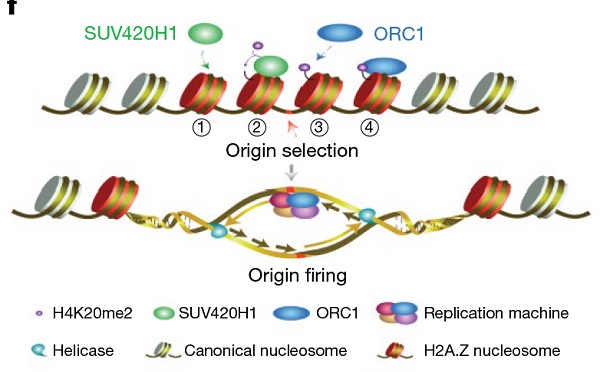
李国红课题组结合生物化学和细胞生物学实验发现,含有组蛋白变体H2A.Z的核小体能够通过直接结合甲基化酶SUV420H1,促进核小体上的H4组蛋白第20位赖氨酸发生二甲基化修饰(H4K20me2)。而带有H4K20me2修饰的H2A.Z核小体,能够招募复制前体复合物中的ORC1(Origin Recognition protein 1)蛋白,从而帮助染色质上复制起始位点的选择。通过全基因组学分析,该课题发现在HeLa细胞中,H2A.Z与H4K20me2、ORC1以及被激活使用的复制起始位点在全基因组上有非常高比例的共定位。而当在HeLa细胞中敲低H2A.Z时,H4K20me2、ORC1以及复制信号都有大幅降低。进一步的研究发现,受H2A.Z调控的复制起始位点比其他的复制起始位点有更高的复制信号,并偏向在复制期早期被激活使用。
为了研究这个通路在生理条件下的作用,李国红课题组与朱明昭课题组合作,构建了在小鼠T细胞中条件性敲除H2A.Z的小鼠。研究结果也发现,在T细胞中条件性敲除H2A.Z会导致活化后的T细胞增殖变慢,复制信号显著降低。
该工作的通讯作者为感染与免疫院重点实验室的朱明昭研究员和生物大分子国家重点实验室的李国红研究员。李国红课题组的龙海珍,张力圩,温增麒,以及朱明昭课题组的吕梦婕为本文的共同第一作者。朱明昭课题组的金彩薇,生物物理研究所质谱平台杨福全课题组的陈秀兰,清华大学邓海腾课题组的张文浩,北京大学裴剑锋课题组的李佟清对该工作也有重要贡献。该课题获得国家自然科学基金、国家重点研发计划项目、中科院先导项目以及中科院前沿科学重点研究计划的资助。
文章链接: https://www.nature.com/articles/s41586-019-1877-9
(供稿:李国红研究组)
附件下载: