
王艳丽组揭示Cas9切割DNA
CRISPR/Cas系统是广泛存在于细菌和古菌中抵抗病毒、质粒等外源核酸的获得性免疫系统。II型的Cas9在RNA的介导下可以特异性的识别、切割dsDNA,具有可编辑性。因此被广泛用作基因编辑工具。由于其重要性,Cas9被系统地研究,大量的文献报道了Cas9的原子分辨率结构、单分子测量结果、分子动力学模拟计算结果,阐明了Cas9切割DNA的分子机理。但是,之前发表的Cas9结构中,切割目的DNA的HNH催化口袋远离切割位点,Cas9处于非活性的状态。而活性状态下的结构是真正理解Cas9切割DNA的作用机制所必需的。另外,目前被广泛使用的SpyCas9,因受其大小的限制,很难与sgRNA一起通过单一AAV病毒导入。而近年来新鉴定的NmeCas9则由于其相对比较小和脱靶率低的原因,有望成为一个更好的编辑工具,但其分子机制尚未被揭示。
噬菌体编码的具有抑制CRISPR-Cas系统功能的蛋白被称为anti-CRISPR蛋白,这些蛋白可以作为基因编辑开关,调控Cas9的活性。2016年,多伦多大学的Karen Maxwell课题组首次报道了AcrIIC1、AcrIIC2和AcrIIC3三种可以抑制NmeCas9的anti-CRISPR蛋白。王艳丽课题组曾与Maxwell课题组合作阐明了AcrIIC2通过阻碍Cas9与sgRNA的结合抑制Cas9活性的机制;但是目前AcrIIC3的抑制机理还不清楚。
2019年10月24日,王艳丽课题组的研究论文“Structures of Neisseria meningitidis Cas9 Complexes in Catalytically Poised and Anti-CRISPR Inhibited States”在《Molecular Cell》杂志在线发表。该工作报道了NmeCas9的五种不同的状态:sgRNA结合状态、种子区域配对状态、催化前状态、催化状态、切割后产物结合状态的高分辨率结构。这些结构如同电影一样,逐步展示了Cas9切割目的DNA的每一个过程,同时揭示了两种不同的NmeCas9识别两种不同PAM的分子机制,进一步揭示了Cas9切割DNA的分子机制。同时,该工作还报道了AcrIIC3分别与sgRNA结合状态、DNA结合状态Nme1Cas9的复合物结构,揭示了AcrIIC3抑制Nme1Cas9切割活性的分子机理。
Cas9与sgRNA结合形成功能复合物,然后Cas9-sgRNA复合物读取目标DNA的PAM序列,解开目的DNA双螺旋,同时sgRNA和目的DNA配对,产生R-loop,随后Cas9的HNH与RuvC活性中心分别切断DNA的两条链。本研究中的种子区域配对状态的结构,成功捕捉到双螺旋形成的中间过程,即sgRNA识别、结合目的DNA的状态(图1A)。更值得注意的是研究者解析了Cas9 HNH处于催化状态的结构(图1B),并第一次观察到金属离子与HNH活性中心的结合。而上述这两种状态是首次被观测到。
Cas9的HNH结构域具有非常高的柔性,并倾向处于远离切割位点的部位,使得Cas9易处于非活性状态。研究者对HNH结构域进行改造,增强了HNH结构域与目的DNA的相互作用,提高了NmeCas9切割DNA的活性。同时,HNH的催化状态激活RuvC切割另一DNA链的活性。因此,HNH结构域改造后的Cas9切割目的DNA两条链的活性同时得到增强。
为了阐明AcrIIC3抑制NmeCas9活性的分子机理,研究者解析了AcrIIC3和结合sgRNA的NmeCas9形成复合物的结构,以及和结合了sgRNA、DNA的NmeCas9形成复合物的结构。研究表明,两个AcrIIC3单体连接两个NmeCas9复合物(图1C)。AcrIIC3与NmeCas9之间的相互作用将HNH结构域锚定在非活性状态,从而抑制NmeCas9对DNA的切割。
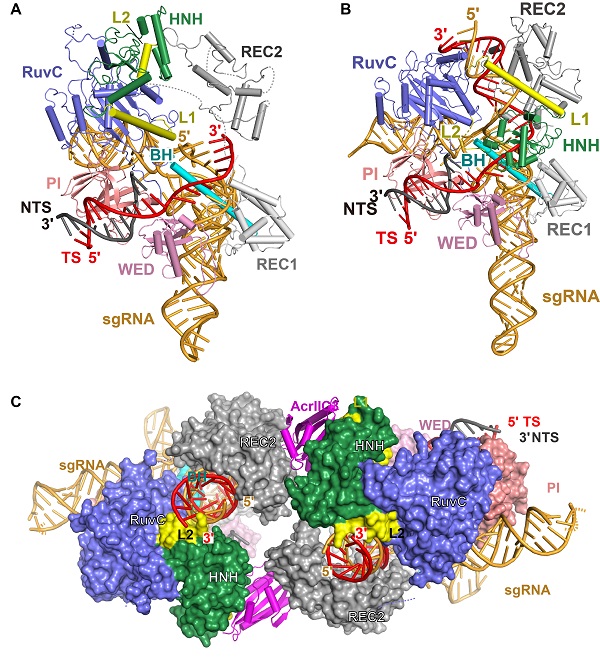
图1. NmeCas9-sgRNA-DNA复合物三种不同状态的晶体结构。
A. 种子区域配对状态;B.催化状态;C. AcrIIC3抑制状态。
这项工作还给大家展示了两种NmeCas9切割DNA的中间状态以及产物结合状态,进一步阐述了Cas9切割DNA的分子机理。需要指出的是,在论文评审过程中,《Nature Structural & Molecular Biology》杂志报道了处于切割后状态的SpyCas9三元复合物结构,整体分辨率3.37angstrom,但是局部的HNH分辨率比较低。王艳丽组报道的催化状态中Cas9三元复合物结构的分辨率更高,为Cas9的改造与应用提供了更有力的理论基础;同时揭示了AcrIIC3抑制NmeCas9切割双链DNA的分子机理 (图2)。
中国科学院生物物理所王艳丽研究员和美国麻省大学医学院Erik Sontheimer教授为本文的共同通讯作者。王艳丽课题组的孙伟、杨晶、程志为本文的共同第一作者。该研究得到科技部、国家自然科学基金以及中国科学院的资助,上海同步辐射光源(SSRF)及日本同步辐射光源(SPring-8)为该研究提供了重要的技术支持。
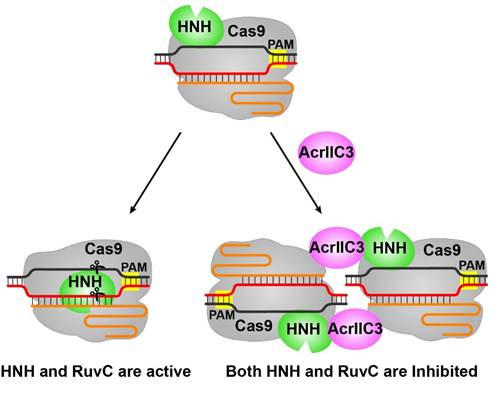
图2. NmeCas9切割DNA以及受AcrIIC3抑制的模型。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30730-0
(供稿:王艳丽研究组)
附件下载: