
卫涛涛、李明等应用单分子技术解析促凋亡
2019年10月9日,国际学术期刊《Nano Letters》发表了中国科学院生物物理研究所卫涛涛课题组与中国科学院物理研究所李明课题组题为“Detection of tBid Oligomerization and Membrane Permeabilization by Graphene-Based Single-Molecule Surface-Induced Fluorescence Attenuation”的合作研究论文。文中通过应用新的单分子研究技术——基于纳米材料氧化型石墨烯表面诱导荧光衰逝的单分子荧光技术(single-molecule surface-induced fluorescence attenuation,smSIFA),解析了Bcl-2家族蛋白tBid与模型膜的相互作用,并揭示了tBid在膜表面通过同源寡聚化形成类孔道结构的动力学过程。
细胞凋亡是一种由多基因调控、在进化上保守的程序性死亡过程,是维持多细胞生物体稳态并清除多余或有害细胞的重要生命过程。在细胞凋亡的内源/线粒体途径中,Bcl-2家族蛋白通过家族之间以及蛋白-膜脂之间的相互作用发挥重要的调控作用,其中对细胞器膜(例如线粒体膜、溶酶体膜等)的通透作用(permeabilization)是调控细胞凋亡过程的关键步骤。促凋亡蛋白Bid参与调控线粒体膜和溶酶体膜的完整性,是联结细胞凋亡的外源和内源途径的桥梁分子。Bid被胱天蛋白酶-8(caspase 8)剪切激活后,tBid(truncated Bid)既可以作为凋亡催化者激活Bax或Bak从而引起线粒体外膜通透,又可以作为凋亡执行者直接诱导线粒体膜或者溶酶体膜的通透。杨福愉/卫涛涛课题组前期的研究结果表明tBid可以与溶酶体膜相互作用并引起膜通透,并进一步证实溶酶体膜上的磷脂酸(phosphatidic acid,PA)是与tBid相互作用的重要分子(Cellular and Molecular Life Sciences 2010;Journal of Lipid Research 2012),然而tBid与生物膜相互作用的动力学过程和蛋白质变构的分子机制仍不明晰。
随着技术的发展,单分子荧光技术渐渐成为研究蛋白质与膜脂相互作用的有力武器。相比于测量分子集体信号的方法,单分子荧光技术可以探测单个分子的运动和特点,提供了整体水平无法观测到的生物分子的复杂性。虽然一些单分子荧光技术,如单分子荧光共振能量转移(single-molecule fluorescence resonance energy transfer,smFRET)技术在研究蛋白与膜脂的相互作用中发挥了作用,但其无法反映出蛋白在膜内纵向运动的精确信息。近期,中国科学院物理研究所李明课题组研发出一种新的纵向亚纳米分辨率的单分子荧光技术——单分子表面诱导荧光衰逝技术(smSIFA)。当荧光分子靠近氧化型石墨烯介质膜表面时,荧光淬灭的效应会随着距离的变化而发生显著的变化。这使得在通过单分子定位技术获得单个蛋白分子在平行于膜表面运动的同时,还能获得垂直于膜表面的运动轨迹。
卫涛涛课题组与李明课题组应用smSIFA技术进行了合作研究,分析了不同位点单标记的tBid在与膜脂作用并诱导膜通透的过程中蛋白的纵向和横向动力学过程。在tBid单体与类溶酶体膜结合时,蛋白整体处于脂双层膜表面的位置,并开始形成同源寡聚体;在寡聚体形成的起始阶段,tBid两个核心的疏水螺旋(α6和α7)插入膜内较浅的位置,而其他螺旋依然在膜表面的位置;在低聚的tBid团簇中,α6和α7在膜内深浅的位置发生动态变化,其他螺旋可能变构到膜的深层位置,导致形成瞬时的二维孔道结构,引起膜通透,进而诱导细胞凋亡。上述smSIFA实验结果也被分子动力学模拟所验证。文中应用smSIFA技术在单分子水平以亚纳米精度分析了tBid与脂质双层之间相互作用的动力学过程,加深了对tBid在溶酶体膜上形成孔道并诱导细胞凋亡的认识和理解。
李明课题组的马丽博士、胡书新博士和卫涛涛课题组的贺小龙博士为本文的共同第一作者,中国科学院生物物理研究所的卫涛涛研究员和中国科学院物理研究所的李明研究员为本文的共同通讯作者。该研究得到了国家自然科学基金、中国科学院基金、王宽诚教育基金、国家重点研发计划的资助。
文章链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02223
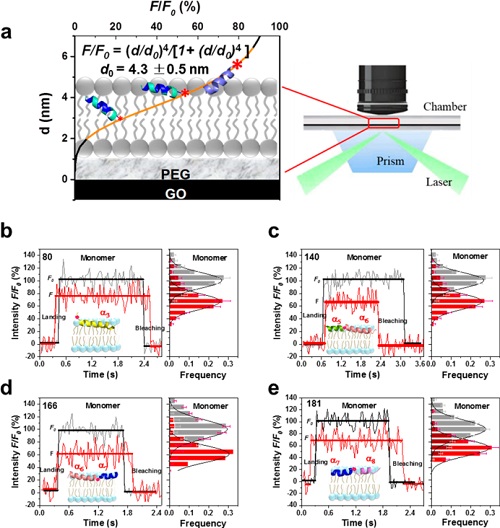
图 smSIFA技术原理和tBid蛋白单体在磷脂膜上的构象变化
(供稿:卫涛涛研究组贺小龙)
附件下载: