
铁蛋白探针:精准靶向肝癌,使其
阎锡蕴课题组在前期利用人铁蛋白特异识别肿瘤标记分子TfR1的特性,将纳米酶精准输送到肿瘤部位,并通过酶催化产生活性氧(ROS)杀伤肿瘤的基础上(Nature Communications 2018),又设计出一种能够特异靶向肝癌,使其可视化并杀死肝癌细胞的新型铁蛋白探针,其作用原理如图所示。
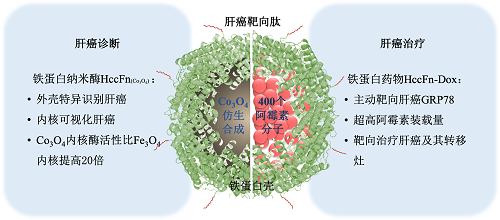
在这项研究中,作者筛选了多种不同种属来源的铁蛋白,最后证明激烈火球菌铁蛋白探针有三个特性:1)识别肝癌:通过基因工程手段在其表面展示肝癌靶向肽SP94,后者特异结合肝癌细胞表面的受体葡萄糖调节蛋白78(GRP78);2)当内腔装载Co3O4纳米酶时,铁蛋白探针催化过氧化物酶底物,使肝癌细胞可视化。研究人员发现,Co3O4纳米酶的催化效率是铁基纳米酶的20倍,提高了肝癌检测的灵敏度;3)当内腔装载阿霉素时,铁蛋白药物精准杀伤肝癌细胞。激烈火球菌铁蛋白可装载400个阿霉素分子,是人铁蛋白载药量的10倍,抗体载药量的50-100倍。
在肝癌诊断方面,通过对424例临床肝细胞癌组织的检测发现,装载Co3O4的铁蛋白纳米酶HccFn(Co3O4)能够将肝细胞癌组织和正常肝组织区分开来,灵敏度为63.5%,特异性为79.1%。这一结果与临床上使用的肝癌标志物甲胎蛋白(AFP)相当;此外,进一步的病理分析表明,探针HccFn(Co3O4)检测结果与肝细胞癌患者预后相关,是肝细胞癌患者预后判断的潜在工具。
在肝癌治疗方面,激烈火球菌铁蛋白药物(HccFn-Dox)在荷肝癌裸鼠模型中高效杀伤肝癌及肺转移后的肝癌组织,而对正常组织无明显副作用。其作用机制可能是,通过铁蛋白表面的肝癌靶向肽SP94特异结合GRP78受体,GRP78介导内吞后进入肝癌细胞溶酶体,在溶酶体酸性环境中铁蛋白裂解释放出阿霉素,后者杀伤肝癌细胞。这项研究有望为肝癌的诊断与治疗提供新思路。
这两项成果近期分别发表在ACS Applied Materials & Interfaces和Theranostics杂志,中国科学院生物物理研究所阎锡蕴院士、范克龙副研究员为共同通讯作者,中国科学院生物物理研究所博士生江冰为第一作者。其中肝癌诊断应用研究工作是与北京大学肿瘤医院合作完成,该单位的郝纯毅教授为该文章的共同通讯作者,博士生阎靓为并列第一作者。本研究得到了国家科技部、国家自然科学基金委和中国科学院的支持。
文章链接:https://pubs.acs.org.ccindex.cn/doi/abs/10.1021/acsami.8b20942
http://www.thno.org/v09p2167.pdf
(供稿:阎锡蕴研究组)
附件下载: