
王志珍课题组报道靶向内质网蛋白质氧化
近日,《柳叶刀》旗下《EBioMedicine》杂志在线发表了来自中国科学院生物物理研究所的研究论文“Targeting the functional interplay between endoplasmic reticulum oxidoreductin-1α and protein disulfide isomerase suppresses the progression of cervical cancer”。该研究发现了负责内质网蛋白质氧化折叠的主要通路在宫颈癌发生中起到重要作用,破坏该通路得以有效抑制宫颈癌进展。
宫颈癌是一种在女性中发病率和死亡率均位居前列的恶性肿瘤。尽管宫颈癌疫苗已经在预防宫颈癌方面起到了重要作用,但目前的治疗手段仍主要为手术、放疗和化疗。这些手段的风险和副作用较大,病人生存质量也有待提高。因此创新治疗手段、探索有效靶标成为亟待解决的问题。癌细胞有旺盛的生命活动和失控的生长势头,其蛋白质的合成和加工也异常活跃。许多细胞因子和膜受体分子都富含二硫键,需要通过分泌途径经过氧化折叠。在细胞内质网中,蛋白质氧化折叠的主要通路由巯基氧化酶Ero1α和蛋白质二硫键异构酶PDI构成。PDI负责催化底物蛋白中二硫键的形成,而Ero1α则负责为PDI 提供上游氧化力,这一过程消耗O2,同时产生H2O2。
本研究首先通过检测临床样本及组织芯片中Ero1α的蛋白表达,发现Ero1α在宫颈癌中明显上调,其表达量与宫颈癌的恶性程度呈正相关,与病人预后呈负相关。在宫颈癌细胞系HeLa中将ERO1A基因敲除后,癌细胞的生长速度明显减慢、迁移和侵袭能力下降、在小鼠皮下成瘤的能力也明显减弱,这一现象可通过H2O2-相关的上皮间充质转化(EMT)机制实现。随后,通过定点突变、活力测定以及蛋白互作等实验,研究者发现Ero1α与其下游的搭档蛋白PDI相互作用的关键位点为Ero1α的101位缬氨酸残基(Val101),该位点特异地识别PDI的催化结构域。突变该位点之后,Ero1α-PDI相互作用被破坏、两者复合物减少、Ero1α的氧化酶活力下降。表达Ero1αVal101突变体的HeLa细胞也呈现生长减缓、迁移和侵袭能力下降以及小鼠皮下成瘤能力降低的表型。
本研究首次将蛋白质氧化折叠与宫颈癌联系起来,并揭示了其分子机制。鉴于Ero1α和PDI在许多癌症中均高表达,本工作从概念上证明开发靶向Ero1α-PDI互作界面的药物有望作为抑制肿瘤生长和癌症发生的新策略。
中科院生物物理所王志珍院士课题组王磊副研究员为论文的通讯作者,博士生张旖旎为论文的第一作者。该研究得到了生物物理所卫涛涛研究员以及温州医科大学第一附属医院吕斌教授的大力支持,并受到国家重点研发计划、国家自然科学基金以及中科院青年创新促进会等项目的资助。
文章链接:https://www.ebiomedicine.com/article/S2352-3964(19)30119-7/abstract
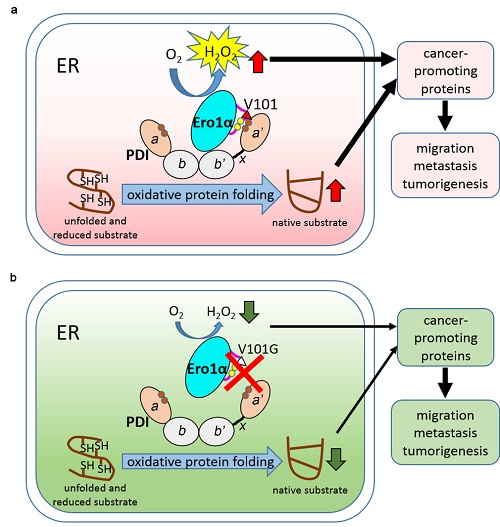
图示:破坏Ero1α-PDI的相互作用抑制宫颈癌进展
(供稿:王志珍研究组)
附件下载: