
李栋课题组研究成果“创建出可探测细胞内结构相互作用的
2月27日,科技部基础研究管理中心公布了“2018年度中国科学十大进展”,中科院生物物理研究所李栋课题组的研究成果“创建出可探测细胞内结构相互作用的纳米和毫秒尺度成像技术”成功入选。
“中国科学十大进展”遴选活动至今已成功举办14届,旨在宣传我国重大基础研究科学进展,激励广大科技工作者的科学热情和奉献精神,开展基础研究科普宣传,促进公众理解、关心和支持基础研究,在全社会营造良好的科学氛围,在科技界深具影响。
入选成果“创建出可探测细胞内结构相互作用的纳米和毫秒尺度成像技术”简介如下:
真核细胞内,细胞器和细胞骨架进行着高度动态而又有组织的相互作用,即“细胞器互作”。在此过程中,细胞器之间进行蛋白质和脂类的交换及信号的传递,高效的协调复杂的细胞功能。观测这些相互作用,需要对细胞内环境进行非侵入式、长时程、高时空分辨、低背景噪声的成像。
从贴壁细胞的形态分析,大多数细胞器通常分布在靠近基底膜1微米的深度范围内。然而,这一深度范围已经超出了全内反射结构光照明超分辨荧光显微镜(TIRF-SIM)技术的成像深度。中科院生物物理研究所李栋课题组发现,当激发光的入射角略低于发生全反射的临界角时,可以获得与物镜景深相匹配的照明深度。这种略低于全反射临界角的照明方式被称为掠入射照明(Grazing Incidence),因此使用掠入射照明方式取代全内反射照明的新型结构光照明超分辨显微镜被称为掠入射结构光超分辨显微镜技术(GI-SIM)。基于上述改进优化,与李栋研究员先前开发的全内反射结构光照明超分辨成像技术(TIRF-SIM)相比,GI-SIM的成像深度以及所产生的信号量都提高了10倍,可以连续成像近万幅超分辨图像;与传统共聚焦或转盘共聚焦显微镜相比,GI-SIM可提供2倍更高的空间分辨率以及10倍更快的成像速度;与其它超分辨成像技术相比,在细胞尺寸的视场范围下,GI-SIM可提供~10倍更快的成像速度,以及10-100倍更长的成像时程;结合高精度控制系统、自主设计的偏振旋转半波片和插值重建算法;最终,GI-SIM实现了在97纳米分辨率下以266幅每秒成像速度连续成像几千幅的成像性能,可对1微米深度范围内的细胞器动态进行最优化二维超分辨成像。图1展示了GI-SIM技术同时观察5种不同荧光标记的细胞器。GI-SIM图像被《Nature》杂志评论为“水晶般清晰”(Crystal Clear)的荧光图像。
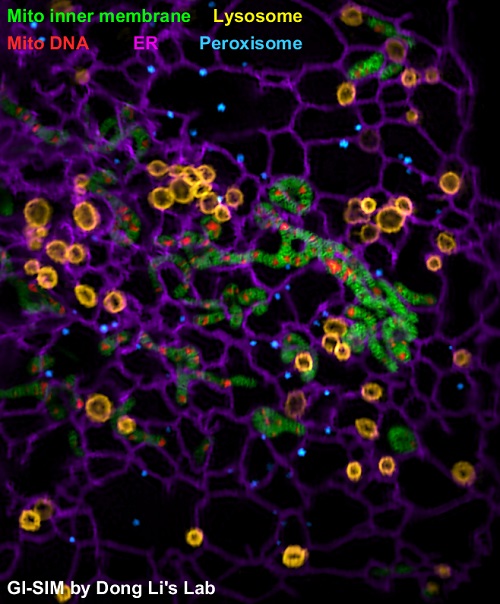
图1 GI-SIM成像细胞器的互作行为
使用GI-SIM技术同时观察5中不同种类的细胞器,绿色为线粒体内脊,红色为线粒体DNA,黄色为溶酶体,紫色为内质网,蓝色为过氧化物酶体。
研究人员利用多色GI-SIM技术揭示了细胞器-细胞器、细胞器-细胞骨架之间的多种新型相互作用,深化了对这些结构复杂行为的理解。微管生长和收缩事件的精确测量有助于区分不同的微管动态失衡模式。此外,在已知的内质网(endoplastic reticulum, ER)延伸方式的基础上,如图2A和2B,李栋团队使用GI-SIM分析了内质网与微管之间的相互作用,并发现了另外三种新的内质网重塑机制:(1)微管解聚端牵引(Depolymerizing Tip Attachment Complex,dTAC,管状内质网的末端受到微管解聚末端拉伸而生长),如图2C;(2)搭便车(Hitchhiking,管状内质网的末端粘附在沿着微管运动的其它细胞器上,如:线粒体、溶酶体等,随着细胞器的运动,管状内置网发生延伸融合),如图2D;(3)微管非依赖型生长(Budding,管状内置网的延伸不直接或间接的依赖微管),如图2E。
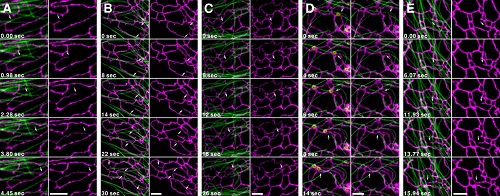
图2内质网的五种不同延伸方式
A滑行,B微管聚合端共生长,C微管解聚端牵引,D搭便车,E微管非依赖。
图中绿色代表微管,紫色代表内质网,金色代表溶酶体,标尺为2微米
在过去的研究中,生物学家认为内质网网络结构的改变仅通过延伸融合的方式完成。李栋团队发现处于运动状态的溶酶体可以引起管状内质网的瞬时断裂。此外,李栋团队通过GI-SIM成像不仅证实了大约85%的线粒体分裂事件确实发生在线粒体-内质网接触位点,还进一步发现约60%的线粒体融合事件也发生在线粒体-内质网接触位点,而且这些发生在线粒体-内质网接触位点的线粒体融合事件通常快于那些没有发生在与内质网接触位点的融合事件,这表明线粒体-内质网间的互作很可能在线粒体的动态平衡调控中发挥着关键作用。
GI-SIM成像技术不仅是研究贴壁细胞内细胞器动态的理想工具,李栋团队还进一步拓展了其应用范畴。例如,GI-SIM可用于研究原代培养的小鼠海马神经元,捕捉到了突触内的微丝细胞骨架的动态重组和突触形变的关联过程;GI-SIM还可对果蝇胚胎的表层细胞进行高质量成像,揭示了果蝇胚胎发育背部融合过程中羊浆膜细胞内微丝骨架周期性聚合与解聚导致羊浆膜细胞发生上下振动的动态过程。
这一工作不仅开发了掠入射结构光超分辨显微成像技术(GI-SIM),而且利用其发现了多种细胞器和细胞骨架的相互作用新行为,拓展了生物学家对细胞器相互作用功能的认知。最后值得一提的是,GI-SIM成像技术的硬件系统能够兼容李栋研究员之前开发的全反射结构光(TIRF-SIM)、三维结构光(3D-SIM)和非线性结构光(nonlinear SIM)超分辨成像技术,形成多模态结构光超分辨成像系统,满足生物学研究中大多数荧光成像实验的需求。
中国科学院外籍院士、美国杜克大学Xiao-Fan Wang教授评论认为,这项工作发展了一项可视化活细胞内的细胞器与细胞骨架动态相互作用和运动的新技术,将会把细胞生物学带入一个新时代,有助于更好地理解活细胞条件下的分子事件,也提供了一个从机制上洞察关键生物过程的窗口,可对生命科学整个学科产生重大影响。
(供稿:科技处、李栋研究组)
附件下载: