
高光侠研究组发现宿主抑制病毒蛋白质
2019年1月24日,中国科学院生物物理所感染与免疫重点实验室高光侠研究组在Cell杂志发表了题为“Regulation of HIV-1 Gag-Pol expression by Shiftless, an inhibitor of programmed -1 ribosomal frameshifting”的研究成果。该研究鉴定到一个新的宿主抗病毒因子(命名为Shiftless, 简称SFL),抑制蛋白质翻译过程中的程序性-1位核糖体移码(Programmed -1 Ribosomal Frameshifting)。
病毒感染可对人类健康造成严重威胁。作为最小的可复制的生物体,病毒又是一种重要的模式生物,许多具有普遍意义的生物学规律最初都是在病毒中发现的。由于体积的限制,病毒的基因组通常比较小,所携带的遗传信息比较少。病毒在复制过程中,会利用一些特殊的机制扩展其所携带遗传信息的利用率,其中一种常用的机制是称为程序性移码的蛋白质合成重编码机制。病毒RNA上含有程序性移码信号,核糖体翻译蛋白过程中遇到此信号时会发生停顿,其中大部分核糖体以原来的读码框翻译,但有一小部分核糖体在RNA上发生滑动,以新的读码框继续翻译。结果是病毒利用一条RNA为模板翻译产生两种蛋白,其N-端序列相同,但C-端序列不同。如果核糖体后退1个核苷酸,则称为-1位程序性移码。HIV病毒利用-1位程序性移码翻译结构蛋白Gag和包含复制酶的Gag-Pol蛋白,是病毒复制过程中必须的一个步骤。
在与病毒长期共存过程中,宿主进化产生了多种抗病毒机制。针对-1位程序性移码这样一个常被病毒利用的方式,人们很久之前就认为宿主应该存在相应的抗病毒机制,但相关研究一直没有突破性进展。
高光侠团队长期研究病毒与宿主相互作用的分子机理,最近发现了能够有效抑制-1位程序性移码的宿主抗病毒因子Shiftless。该蛋白对来自多种病毒及宿主mRNA的-1位程序性移码均有明显的抑制作用。进一步研究表明,Shiftless通过结合-1位移码翻译过程中的核糖体及mRNA干扰核糖体的移码过程。
程序性移码机制最早在病毒中发现,但后来发现该机制在所有生物中均存在,而且除了用于翻译重编码,还可以调控mRNA的稳定性。在高等生物mRNA中,生物信息学预测,含程序性移码信号的mRNA可能多达2000个,但目前为止经过验证的只有极少数几个。对程序性移码的研究一方面可以为抗病毒提供新的靶点,另一方面有助于更深入了解基因表达的调控机制。但是,目前人们对程序性移码是如何调控的却知之甚少。Shiftless的发现为进一步深入研究-1位程序性移码的作用机理提供了有效的工具,不仅在抗病毒研究领域,也在其它领域中有着重要的前景。
高光侠研究员为本文通讯作者,课题组副研王新路、助研宣依昉和博士生韩玉岭是本文的共同第一作者。生物物理所杨福全研究员、高璞研究员、丁翔高级工程师和美国哥伦比亚大学Stephen P. Goff教授参与了相关研究。该研究得到来自国家自然科学基金委、科技部、卫健委和中国科学院等部门的基金支持。
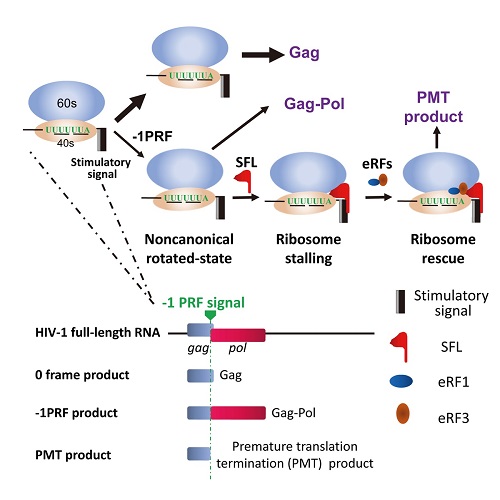
图 SFL 抑制-1PRF 机制模式图
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(18)31644-1
(供稿:高光侠研究组)
附件下载: