
李栋课题组开发新型超分辨成像技术揭示细胞器互作新现象
2018年10月25日,中国科学院生物物理研究所李栋课题组与美国霍华德休斯医学研究所Eric Betzig博士、Jennifer Lippincott-Schwartz博士合作在《Cell》杂志发表研究论文“Visualizing intracellular organelle and cytoskeletal interactions at nanoscale resolution on millisecond timescales”。该文首创了掠入射结构光照明超分辨成像技术(GI-SIM),可对细胞内的生理过程进行高速、长时程、超分辨率成像,利用该技术发现了多种细胞器间相互作用新行为。
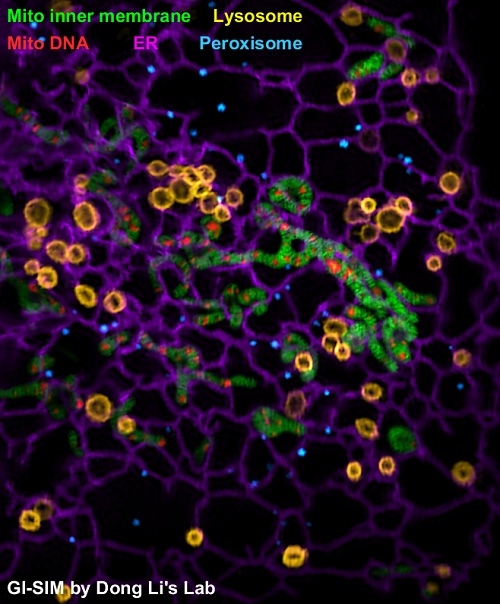
GI-SIM可对活细胞以97纳米分辨率,266幅每秒的成像速度连续成像近万幅超分辨图像。与李栋研究员先前开发的全内反射结构光照明超分辨成像技术(TIRF-SIM; Li et al., Science, 2015)相比,GI-SIM的成像深度以及所产生的信号量都提高了10倍;与传统共聚焦或转盘共聚焦显微镜相比,GI-SIM可提供2倍更高的空间分辨率以及10倍更快的成像速度;与其它超分辨成像技术相比,在细胞尺寸的视场范围下,GI-SIM可提供~10倍更快的成像速度,以及10-100倍更长的成像时程。GI-SIM实现了对细胞内多种细胞器动态的最优化二维超分辨成像,这使得研究人员发现了多种细胞器互作新行为。例如:
(1)管状内质网的三种新型延伸方式。
内质网的网络结构的形成是由管状内质网的不断延伸和融合完成的。之前的研究工作指出,管状内质网的延伸方式存在滑行(Sliding)和微管聚合端共生长(pTAC)两种,本文发现了:微管解聚端牵引(dTAC)、搭便车(Hitchhiking)和微管非依赖(Budding)三种管状内质网延伸方式。
(2)线粒体与内质网的互作影响线粒体的分裂与融合。
线粒体的分裂与内质网关系密切,统计发现有大约85%的线粒体分裂事件发生在线粒体与内质网的接触位点(contact sites)。我们进一步发现约60%的线粒体融合事件发生在线粒体与内质网的接触位点,并且与内质网接触的线粒体融合事件通常快于那些没有与内质网接触的融合事件。
(3)多色GI-SIM成像发现溶酶体-内质网互作对调控溶酶体在细胞内的动态运输和分布起关键作用。
(4)过去的研究仅发现内质网可通过融合来改变其网络结构,本文首次观测到处于运动状态的溶酶体可引起管状内质网的瞬时断裂。
(5)本文首次在哺乳动物细胞中证实不同种细胞器间存在广泛的“搭便车”(Hitchhiking)互作现象,并观测到线粒体、内质网等细胞器的形态改变和迁移可通过搭载到其它正在运动的细胞器上实现,而无需其直接招募马达蛋白。
李栋课题组博士研究生郭玉婷和助理研究员李迪为并列第一作者、博士研究生张思微为第二作者。李栋研究员和Eric Betzig博士、Jennifer Lippincott-Schwartz博士为共同通讯作者。中科院遗传与发育生物学研究所刘佳佳课题组、杜克大学Dan Kiehart课题组合作参与了本课题。
该课题得到中科院先导B类项目、国家自然科学基金、国家重点研发计划项目的资助。
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(18)31308-4

(供稿:李栋课题组)
附件下载: