
纳米酶催化治疗肿瘤
2018年4月12日,《Nature Communications》杂志在线发表了中国科学院生物物理研究所阎锡蕴课题组与扬州大学医学院高利增课题组合作完成的纳米酶催化治疗肿瘤的最新研究成果。这项研究首次证明通过对纳米酶多酶体系的体内活性调控,可以将肿瘤代谢产物催化为毒性物质,实现对肿瘤的特异性杀伤。该研究是继发现纳米酶,并将其应用于肿瘤体外诊断(Nature Nanotechnology 2007,2012)之后,首次将纳米酶直接用于体内肿瘤治疗。这项工作不仅将纳米酶的应用范围从体外诊断拓展到体内治疗,更重要的是为肿瘤治疗提供了一种新的策略。
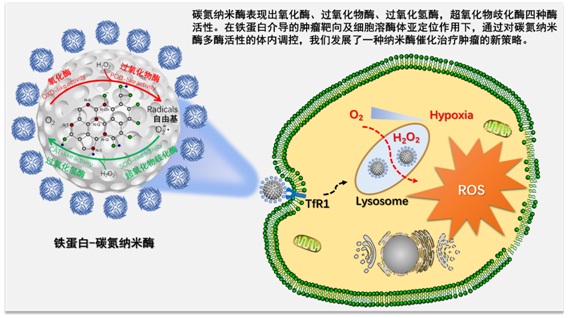
肿瘤代谢具有与正常细胞不同的特征,例如,肿瘤细胞会积累大量的过氧化氢。如何利用肿瘤代谢产物发展“以彼之道,还施彼身”的肿瘤治疗策略是肿瘤生物治疗的新领域。由于过氧化氢可被过氧化物酶催化产生具有细胞毒性的自由基,因此过氧化物酶被寄予开发肿瘤新药物的希望。但是天然酶往往稳定性较差,在复杂的体内环境中容易失活,因而其应用受到限制。本项工作的研究人员另辟蹊径,探索了兼具酶催化活性和纳米材料稳定性的纳米酶在该策略中的应用。
研究人员首先设计合成了具有氧化酶、过氧化物酶、过氧化氢酶及超氧化物歧化酶四种酶活性的新型纳米酶。这种纳米酶多酶活性是通过在介孔碳球中掺杂了氮元素实现的。这种新型碳氮纳米酶在酸性条件下,发挥氧化酶和过氧化物酶活性,可催化氧气和过氧化氢产生活性氧自由基;在中性环境下则主要表现为过氧化氢酶和超氧化物歧化酶活性,可以清除自由基。如何将该纳米酶准确递送到肿瘤细胞并特异激活其产生活性氧自由基的氧化酶和过氧化物酶活性是决定碳氮纳米球能否应用于肿瘤治疗的关键。
研究人员利用铁蛋白对这种新型碳氮纳米酶进行修饰,并通过实验验证了铁蛋白修饰后的碳氮纳米酶可以特异识别肿瘤细胞,并定位于肿瘤细胞内部具有酸性环境的溶酶体中,其氧化酶和过氧化物酶被特异性激活,催化肿瘤内的氧气和过氧化氢产生高毒性的活性氧自由基,实现对肿瘤细胞的特异性杀伤。动物荷瘤实验表明,铁蛋白-碳氮纳米酶可显著抑制肿瘤的生长。
该研究设计发明了具有多重酶活性的新型碳氮纳米酶,并利用铁蛋白的导航,在体内实现纳米酶的精准递送和酶活调控,利用肿瘤特征性的代谢产物,发挥对肿瘤特异而高效的杀伤作用,建立了纳米酶靶向催化治疗肿瘤的新策略,为肿瘤治疗提供了新的思路和技术。
阎锡蕴课题组范克龙副研究员、高利增课题组奚菊群副教授为该论文的共同第一作者。该研究得到了科学院先导项目、国家科技重大专项、国家自然科学基金、青年人才托举工程等项目的资助。
文章链接:https://www.nature.com/articles/s41467-018-03903-8
(供稿:阎锡蕴课题组)
附件下载: