
饶子和与胡俊杰课题组在线粒体膜融合研究方面再获新进展
2018年2月26日,《nature structural & molecular biology》杂志在线发表了饶子和院士课题组和胡俊杰课题组合作的研究论文,“Structural basis for GTP hydrolysis and conformational change of MFN1 in mediating membrane fusion”。该研究解析了线粒体融和素MFN1的最小GTP酶单位(MFN1-MGD)在结合GDP-BeF3-状态下形成的二聚体结构,提出了MFN1通过螺旋束摆动的构象变化把栓连的膜拉近以促进膜融合的分子机制模型。
线粒体是由双层膜包被的细胞器,在细胞内持续发生融合和分裂以维持其正常功能。Mitofusin (MFN)位于哺乳动物细胞的线粒体外膜用于介导膜融合,包括MFN1和MFN2。细胞中缺失其中的任一基因,都会导致线粒体破碎;小鼠体内的其中任一基因被破坏都会发生胚胎致死。并且MFN2的基因突变与神经退行性疾病-2A型腓骨肌萎缩症(CMT2A)的发生密切相关。但是由于全长的MFN蛋白非常难以表达纯化,故对其介导线粒体同源膜融合的分子机制仍旧不甚明了。
饶子和院士和娄智勇博士的团队在解析MFN1-MGD单体结构的基础上(JCB,2016),又成功解析了该蛋白在结合GDP-BeF3-状态下形成的二聚体结构,其二聚体交界面积较之前报道的二聚体交界表面积更大,并且其螺旋束1(HB1)相对于GTP酶结构域的构型发生巨大改变,本研究将此状态命名为螺旋束闭合状态(HB-closed),与之前的螺旋束开放状态(HB-open)相对应。胡俊杰课题组通过酶活力测定和FRET等一系列体外实验和MFN1敲除的MEF细胞的回补实验,证明了MFN1由开放到闭合二聚体的转变将两个栓连的膜拉在一起从而促进膜融合。此外,本研究发现在酶的催化中心,MFN1水解GTP对K+有特异的依赖性。
本研究类比已知结构的细菌发动蛋白类似蛋白(BDLP),提出MFN1水解GTP导致螺旋束构象改变,从而将相邻的栓连的膜拉近以促进膜融合的分子机制模型,并通过导致产生CMT2A疾病的MFN2的点突变实验证明了其结构的构象变化与疾病的相关性。这种膜融合的分子机制也同样适用于MFN2和Fzo1p,以及其他物种中的同源蛋白。
胡俊杰研究员和清华大学的娄智勇教授是本文的共同通讯作者。饶子和课题组的闫利明、余彩婷以及胡俊杰课题组的齐元博、黄小芳为本文的共同第一作者。该研究得到国家重点研发计划,国家自然科学基金和霍华德休斯医学研究所(HHMI)国际青年科学家基金等的支持。
文章链接:https://www.nature.com/articles/s41594-018-0034-8
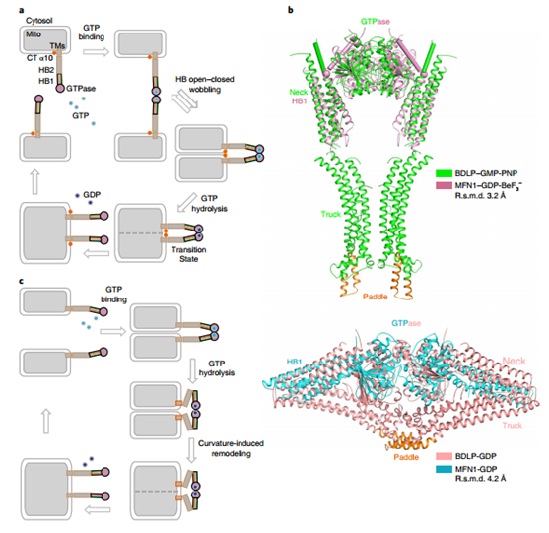
图示:MFN介导线粒体膜融合的模式图
(供稿:胡俊杰课题组)
附件下载: