中科院与牛津大学合作解析甲肝病毒与中和性抗体复合物三维结构
2017年1月10日,《PNAS》在线发表了中科院生物物理研究所饶子和课题组和牛津大学David Stuart课题组合作的研究论文 “Potent neutralization of Hepatitis A virus reveals a receptor mimic mechanism and the receptor recognition site”,解析了甲肝病毒与其中和性抗体Fab复合物精细三维结构,通过病毒学和细胞生物学实验证明:该抗体不仅能够阻断HAV与其受体TIM-1分子的相互作用,还干扰了HAV病毒正常的脱衣壳过程,揭示了一种“Receptor Mimic”的中和机制,为抗病毒药物研发提供重要信息。
全球每年仍然有140万甲型肝炎病毒(HAV)感染病例,主要爆发于发展中国家。HAV病毒属于小RNA病毒科肝炎病毒属,尽管HAV病毒是较古老的病毒,虽然其灭活病毒制备的疫苗上市多年,但是仍然很多科学问题尚未研究清楚。2015年饶子和研究团队解析了HAV全病毒颗粒的晶体结构,揭示了HAV独有的结构特性、极强的稳定性和小RNA病毒的进化关系。然而,HAV的受体结合位点以及具有极强稳定性的病毒是如何发生脱衣壳的分子机制还是不清楚。
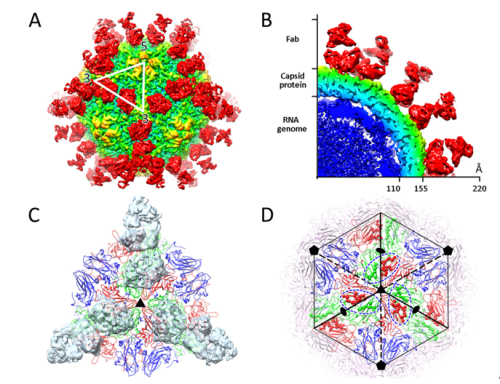
本研究结合低温冷冻电镜技术、X射线晶体学和病毒学技术,解析了HAV病毒实心颗粒(3.4埃,约4500颗粒)、HAV病毒空心颗粒(3.9埃,约4000颗粒)和HAV病毒实心颗粒与抗体复合物(4.1埃,约1500颗粒)以及中和性抗体R10 Fab的晶体结构,确定了精细抗原表位,且该抗原表位在6株人类甲型肝炎病毒均高度保守。R10结合在病毒五次轴一圈正电荷富集的区域,该区域被实验证明为TIM-1分子mucin domain糖链结合的位置;此外R10的轻链与TIM-1分子Ig V domain 有很高的结构相似性。结合功能性数据结果:R10能够阻断HAV分子与TIM-1分子的结合和干扰HAV脱衣壳的特性,从结构和功能上提出了一种“受体模拟”的中和机制。
该研究对于阐述HAV病毒的受体结合位点和脱衣壳过程具有重要意义,对于抗HAV病毒药物的研发提供理论指导和新方向。饶子和院士、David Stuart教授、王祥喜研究员、Elizabeth Fry博士为本文的共同通讯作者,朱玲博士、党明浩博士和胡忠玉博士为共同第一作者,该研究得到中国科学院先导项目“超大分子复合物”、国家973项目、国家自然科学基金以及国家重大传染病专项的大力支持。
图一. HAV与中和性抗体复合物整体结构
(供稿:饶子和课题组)
附件下载: