生物物理所研究人员在《PNAS》上发表文章
2016年11月1日《PNAS》杂志在线发表了生物物理所题为“Structural basis for DNA recognition by STAT6”的研究论文,首次揭示STAT6对N4位点DNA的识别机制。
人类的病毒性感染十分普遍,多数为隐性感染而不易被发现,如成人几乎都感染过单纯疱疹病毒;少数则发生显性感染,可引起突发性或慢性传染病,如病毒性肝炎、艾滋病,近期在西非发生的埃博拉出血热等。病毒与宿主在长期进化过程中相互作用引发机体出现了复杂而精细的免疫机制,天然免疫反应就是宿主抵抗病毒感染的第一道屏障。天然免疫如同机体的眼睛,监视与识别各种外来微生物入侵。机体通过启动免疫反应,引发一系列抗病毒基因表达,最终利用炎症反应来清除感染,了解这一分子基础是天然免疫研究的重要内容。
2011年,北京大学蒋争凡教授课题组通过cDNA表达文库的功能性筛选,发现了通过STING-TBK1可以激活原本在适应性免疫中发挥重要功能的转录因子STAT6(signal transducer and activator of transcription 6),揭示其在抗病毒天然免疫通路中也有重要作用。其研究从分子、细胞到动物整体多个层次揭示了转录因子STAT6在机体天然免疫和适应性免疫中发挥双重作用的分子机制,研究结果将为STING介导的宿主天然免疫反应提供新的补充,为人类对病毒感染导致的自身免疫性疾病、多器官慢性炎症的诊治和抗御病原微生物感染的分子机制研究提供新思路。
STING有关的信号通路一直是我们关注的领域,STAT6因与STING有相互作用引起我们的注意。此前报道STAT6作为信号转导及转录激活因子家族中的一员,参与到JAK-STAT信号通路,受到IL-4/IL-13的调控,将信号从细胞膜传递到细胞核并激活下游一系列基因的转录表达,在Th2细胞的分化过程中起到关键作用。STAT6表达与炎症和多种肿瘤关系密切,可能成为新的肿瘤标志物,检测STAT6分子具有重要临床意义,可以作为判断预后的指标和治疗的新靶点,筛选出该通路的抑制分子就可能成为STAT6通路的异常所致疾病的潜在预防和治疗的作用药物。STAT6家族蛋白作为转录因子首先在胞质中磷酸化后形成二聚体,二聚体的STAT6进入细胞核并识别和结合靶基因启动子区域启动一系列基因表达。STAT家族蛋白识别相似的DNA序列,其基本结构为TTCN3/4GAA,但是不同的STAT蛋白所识别的DNA回文序列的中间间隔区长度不同。在哺乳动物STAT家族中,STAT6是唯一一个主要识别N4位点启动子(TTCN4GAA)的家族成员,而其他STAT家族蛋白以识别N3位点启动子(TTCN3GAA)为主。对于这种对DNA识别差异的结构基础,至今仍缺乏比较合理的机制阐述,尤其STAT6对N4位点DNA的识别机制是过去10多年一直没解决的一个重要科学问题。
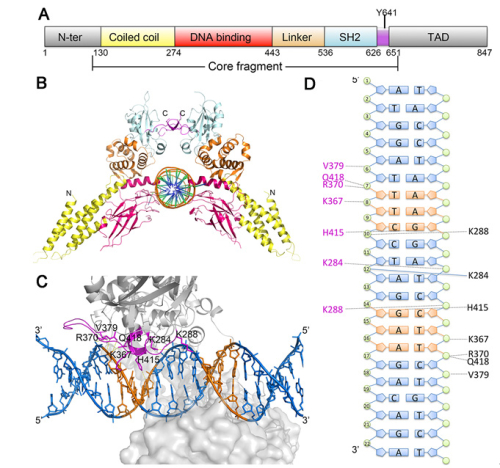
本研究采用结构生物学方法解析了STAT6核心区的磷酸化二聚体晶体结构,同时完成其与N4位点DNA和N3位点DNA两个复合物三维精细结构的解析工作,这是其它STAT家族蛋白中从来没有过的,因此我们有足够的结构资源进行结构分析。STAT6核心区的磷酸化二聚体结构与其它已解析STAT蛋白结构采用相似机制形成“V”字形。通过结构比对发现,结合核酸以后,STAT6二聚体发生一个明显的旋转型的构象变化,同时发现结合N4位点DNA和N3位点DNA后STAT6关键氨基酸H415在DNA双螺旋轴方向的位置变化距离与DNA双螺旋中相邻2个碱基之间的垂直距离(approximately 3.4 ? rise/bp along the axis of a B-DNA double helix)相符。这部分工作是在STAT蛋白家族中首次针对同一STAT蛋白观察到结合DNA前后的构象变化。分子动力学模拟以及小角散射实验的结果都证明了STAT6的构象在DNA结合后处于更稳定的状态。通过与其它已报道STAT蛋白结构比较发现,STAT6磷酸化二聚体中“V”形的夹角比其它STAT蛋白要大一些,导致二聚体结构中的两个分子之间的动态变化范围更广。同时我们发现,STAT6 DNA结合结构域上的H415是唯一与DNA碱基直接相互作用的氨基酸,这引起我们的关注。序列分析发现除STAT5以外,在其它STAT蛋白上H415所对应的氨基酸是N(Asn)。体外实验发现,STAT6的H415突变成N后识别N4位点DNA的能力明显下降而识别N3位点DNA的能力上升,而将STAT1上相应的氨基酸N460突变成H后识别N3位点DNA的能力明显下降而识别N4位点DNA的能力上升。细胞水平实验也证明STAT6的H415对STAT6特异性结合N4位点DNA具有关键作用。STAT5不能广泛识别N4位点DNA可能是因为一方面STAT5二聚体夹角稍小,另一方面H471的侧链伸展方向与STAT6的H415不同。
本研究工作欧阳松应研究员为通讯作者,刘志杰课题组博士生李静和美国UCLA程根宏课题组博后Jose Pindado博士为共同第一作者。课题曾获得生物物理所赵永芳课题组、中科院药物所邵强博士团队、天津医科大学杨洁课题组以及芬兰奥卢大学Gong-Hong Wei教授等人的大力帮助。该研究得到国家自然科学基金委、科技部、北京市科委和中科院青促会等基金的资助。
图示:STAT6核心片段在全长中所在的区域及STAT6核心片段与N4位点DNA复合物结构。
(供稿:刘志杰课题组)
附件下载: