
刘志杰课题组在《Cell》报道
2016年10月20日,刘志杰课题组与合作者在《Cell》杂志发表了题为“Crystal Structure of the Human Cannabinoid Receptor CB1”的研究成果。
人源大麻素受体(human Cannabinoid Receptor 1, CB1) 是人的中枢神经系统中表达量最高的G蛋白偶联受体(GPCR)。大麻作为药物使用已有几千年的历史,研究结果显示大麻的主要有效成分 ---- 四氢大麻酚(?9-tetrahydrocannabinol, THC)的主要作用于CB1。CB1是治疗疼痛、炎症、肥胖症以及药物滥用的潜在药物靶点。然而,由于长期以来缺乏CB1的结构信息,基于CB1的药物研发并不顺利,在过去几年中多个国际药企以CB1为靶点的新药研发项目均因严重的副作用终止并造成巨大的经济损失。
人体中80%的细胞跨膜信号转导以及40%的上市药物均与GPCR相关。GPCR与其配体复合物的精细三维结构十分有助于了解药物分子如何影响细胞信号转导,并且可以有效提高药物设计的针对性。
CB1特异性小分子拮抗剂在治疗肥胖及相关并发症、精神性疾病、肝纤维化和尼古丁成瘾等方面显示了不俗的效果。2006年首个CB1特异性拮抗剂利莫那班(Rimonabant, Sanofi-Aventis)获得了欧洲医学委员会(EMA)的上市批准,用于肥胖症的治疗。然而,在美国FDA该药物却因可能引发焦虑、抑郁、自杀倾向等精神方面的副作用而被禁止。由于缺乏对Rimonabant与CB1相互作用分子层面的了解,至今人们对减轻CB1药物副作用的努力收效甚微。因此获得CB1-拮抗剂复合物的三维精细结构,分析其作用机制,可以对CB1 拮抗剂类药物的研发提供新的突破方向及解决方案。CB1的结构信息对于内源性大麻素系统的功能机制研究极其重要,是长期以来困扰该领域的难题。
这篇研究论文的第一作者刘志杰课题组的博士研究生华甜,在她和其它研究人员的共同努力下,解析了CB1-AM6538复合物2.8埃分辨率的晶体结构,该晶体结构揭示了CB1中拮抗剂小分子AM6538复杂的疏水结合口袋。AM6538非共价的紧密结合模式使其具备了成为长效缓释药物分子的巨大潜力,该特性也是治疗成瘾障碍药物的基本要求。此外,通过基于CB1的三维结构的分子对接及动力学模拟分析,本团队还获得了不同类型的小分子激动剂与CB1的结合方式,揭示了配体小分子与CB1相互作用的一些新模式和新见解。总之,该研究揭示出的CB1的三维精细结构对设计更加特异和副作用更小的拮抗剂类药物具有极大的推动作用。
参与该研究工作的合作单位包括:上海科技大学iHuman研究所、美国东北大学(Northeastern University)、南加州大学(the University of Southern California)以及Scripps研究所(The Scripps Research Institute, Florida),加州大学圣地亚哥分校(University of California at San Diego),中国科学院上海药物所和GPCR研究联盟(GPCR Consortium)。
该研究得到了科技部、国家自然科学基金委、上海市政府、美国NIH、美国NFS以及GPCR研究联盟的资助和支持。

图一,人源大麻素受体(CB1)与拮抗剂AM6538复合物的结构展示图。CB1三维结构以浅黄色卡通图表示;拮抗剂AM6538以橙色棍状模型表示。
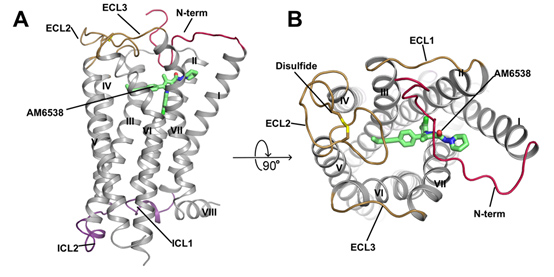
图二,A: 人源大麻素受体(CB1)与拮抗剂AM6538复合物结构的侧视图。CB1的结构以灰色卡通图表示,拮抗剂AM6538以绿色棍状模型表示。B: 人源大麻素受体(CB1)与拮抗剂AM6538复合物结构的俯视图。
(供稿:刘志杰课题组)
附件下载: