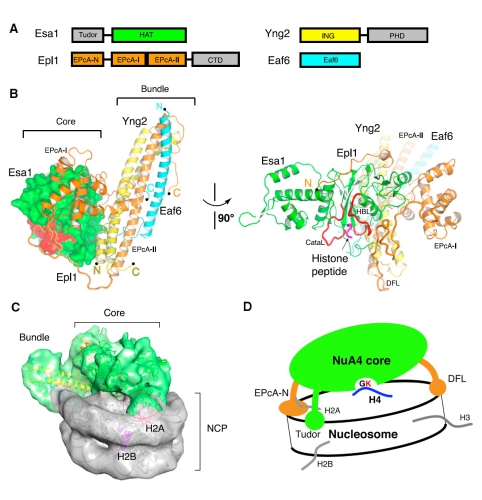
乙酰转移酶NuA4特异识别及乙酰化核小体组蛋白H4的工作机制
2016年9月1日,Molecular Cell 杂志在线发表了清华大学生命学院陈柱成研究组与中科院生物物理研究所朱平研究组合作的、题为“The NuA4 core complex acetylates nucleosomal histone H4 through a double recognition mechanism”的研究论文。该工作通过X-ray晶体衍射以及cryo-EM单颗粒重构等研究手段,阐明了乙酰转移酶NuA4通过“空间—序列”双识别的方式特异性乙酰化核小体组蛋白H4的工作机制。
乙酰化是生物体内重要的表观遗传修饰作用,参与调控基因表达、DNA损伤修复、染色体重组、细胞自噬、癌症发生等重要生命活动。NuA4是酵母体内唯一必需的乙酰化转移酶,以复合物形式发挥功能,其中Esa1、Epl1、Yng2、Eaf6四个蛋白组成其核心复合体(NuA4 core complex, 图A)。陈柱成研究组通过体外重组的方式,成功获得了四元复合体,并通过X-ray晶体衍射的方式获得了该复合体的原子分辨率结构 (图B)。同时,为了探究酶与底物的识别机制,该研究组又分别获得复合体结合乙酰辅酶A,以及底物组蛋白多肽的结构,证明了NuA4乙酰化底物蛋白时,具有短程序列选择性。为了探究复合体特异性乙酰化核小体组蛋白H4的原因,朱平研究组与陈柱成研究组合作,通过cryo-EM单颗粒三维重构方法获得了NuA4核心复合体与核小体结合时的复合物结构(图C)。研究结果显示,NuA4核心复合体通过多个位点结合核小体,使核小体H4 在空间上靠近酶活中心,而其他组蛋白远离催化中心,从而实现对核小体H4的特异性识别并乙酰化。这个工作揭示了在核小体层次,一个更加接近生理条件,组蛋白乙酰化转移酶的一种全新的底物识别与工作机理(图D)。
清华大学生命学院博士生徐鹏、生物物理研究所博士生李承珉为本文共同第一作者,清华大学陈柱成教授及生物物理研究所朱平研究员为本文共同通讯作者。清华大学范仕龙、王佳伟和戴俊彪实验室的研究人员参与了部分工作。该研究得到国家自然科学基金委员会,科技部,中组部和中科院先导项目等经费支持。
NuA4核心复合体“空间—序列”双识别核小体组蛋白H4的示意图
(供稿:朱平课题组)
附件下载: