王大成课题组与北生所合作破解细胞焦亡的关键分子机理
2016年6月8日,中科院生物物理研究所所王大成院士课题组与客座研究员、北京生命科学研究所邵峰院士课题组通力合作,在《Nature》杂志上在线发表题为“Pore-forming activity and structural autoinhibition of the gasdermin family”的研究长文(article),首次解析GSDMD蛋白家族重要成员的三维结构,与生物功能研究有机结合,确证GSDMD为细胞炎性坏死的直接‘杀手’,揭示GSDMD蛋白以及其它gasdermin家族蛋白介导细胞焦亡和在天然免疫中发挥功能的结构和分子机理,为研发自身免疫疾病和败血症等疾病的创新药物奠定了坚实理论基础,开辟了以针对gasdermin家族蛋白为基础的创新生物医药研发新方向,引起高度重视。
细胞焦亡(又称炎性坏死)是机体重要天然免疫反应,在拮抗病原感染和内源危险信号中发挥重要作用。过度的细胞焦亡会诱发包括败血症在内的多种炎症和免疫性疾病。传统认为,细胞焦亡由包括caspase-1和caspase-4/5/11在内的炎性caspase活化而诱发。Caspase-1在病原信号诱导形成的炎症小体复合物作用下被激活;而caspase-4/5/11是细菌脂多糖(LPS,又称内毒素)的胞内受体,在结合LPS后发生寡聚而活化,是革兰氏阴性菌诱导败血症的关键因素。20多年来人们对于炎性caspase如何诱导细胞焦亡的机理一直完全不清楚,在去年的一项突破性进展中,邵峰院士课题组找到了一个所有炎性caspase的共同底物蛋白GSDMD,炎性caspase通过切割GSDMD释放其N端结构域而引发细胞焦亡(Shi et al., Nature 2015)。GSDMD属于一个被称为gasdermin的功能未知的蛋白质家族,该家族还包括GSDMA,GSDMB,GSDMC,DFNA5,DFNB59等蛋白。人的DFNA5和小鼠Gsdma3的遗传突变分别导致非综合征性耳聋和小鼠脱毛以及皮肤发炎等疾病,GSDMB基因的多态性和儿童哮喘的发生密切相关。然而,炎性caspase切割GSDMD如何引发细胞焦亡及其它gasdermin家族蛋白在细胞焦亡相关天然免疫中如何发挥功能的分子机制则仍然不清楚,是当前天然免疫研究的前沿热点问题。
在这项最新的研究中,研究人员首先发现几乎所有的gasdermin家族蛋白的N端结构域都具有诱导细胞焦亡的功能,在细菌中也显示出明显的致死毒性。这一现象暗示gasdermin N端结构域可能是通过直接破坏细胞膜而杀死细胞。随后,研究人员利用活化形式的GSDMD,GSDMA和GSDMA3蛋白通过生化实验发现,这三种gasdermin蛋白的N端结构域均能够特异地结合真核细胞膜上特有的磷酸化磷脂酰肌醇(phosphoinositide)和原核细胞膜上特有的心磷脂(cardiolipin),这与gasdermin N端结构域在真核细胞和细菌中均展示出细胞毒性相一致。通过生物化学和荧光显微成像的细胞实验,研究人员进一步证实,在真核细胞焦亡过程中,活化的gasdermin N端结构域会从细胞质中转移到细胞膜上,细胞随后出现体积膨胀和细胞膜向胞外吐泡的现象。此外,活化的gasdermin N端结构域重组蛋白只能从真核细胞内部破坏细胞膜,而直接加入到细胞培养上清中的蛋白则不能裂解细胞,这与磷酸化磷脂酰肌醇只分布在细胞膜内侧完全吻合。
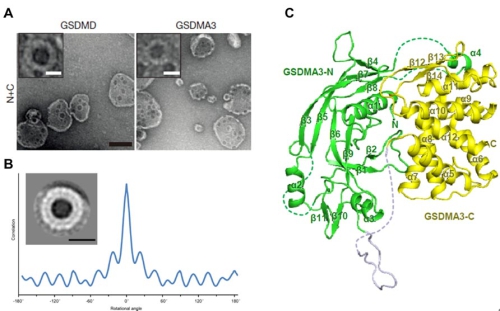
利用脂质体泄漏实验,研究人员进一步发现gasdermin N端结构域能高效特异地破坏含有磷酸化磷脂酰肌醇或心磷脂的脂质体。利用不同尺寸葡聚糖分子,他们发现破坏后的脂质体只能允许小于10纳米尺度的分子被释放,该现象提示gasdermin N端结构域有可能在脂膜上聚合形成规则的孔道。生化交联实验结果证实gasdermin N端结构域在结合脂质体或是在细胞焦亡中转位上膜后都会发生高度聚合。利用负染电镜的方法,他们首次观察到gasdermin N端结构域能在特异磷脂或天然磷脂组成的膜形成很多蜂窝状的孔道,这些孔道的内径约10-14纳米。进一步的电镜分析表明gasdermin N端结构域在膜上形成16元聚合体的孔道。此外,他们还通过对GSDMA3蛋白高分辨率晶体结构的解析,揭示了gasdermin N端结构域作为一种全新的打孔蛋白的独特结构特征,以及与C端结构域之间的精细的自抑制相互作用。基于结构设计的点突变实验结果进一步确认了gasdermin N端结构域结合膜脂和在膜上打孔的特性是其诱导细胞焦亡的分子基础。
这项研究证明了GSDMD是炎性caspase诱导细胞焦亡的直接‘杀手’,首次揭示了gasdermin 家族蛋白的N端结构域具有在膜上打孔进而破坏细胞膜的功能,这不仅清晰阐明了炎性caspase通过GSDMD诱导细胞焦亡的分子基础,也将细胞焦亡的概念重新定义为由gasdermin介导的细胞程序性坏死。研究结果不仅为针对GSDMD开发自身炎症性疾病和败血症的药物奠定了坚实的理论基础,也为后续研究其它gasdermin蛋白在程序性细胞坏死和天然免疫中可能的生理功能开辟了道路。
本研究得到了中科院战略性先导科技专项(B类),国家科技部973项目,国家自然科学基金委员会,以及美国霍华德?休斯医学研究所青年科学家奖的资助。王大成院士课题组的副研究员丁璟珒为本文的第一作者,王大成院士和邵峰院士为本文共同通讯作者。
图示:A. gasdermin N端结构域能在脂质体上形成的蜂窝状孔道;B. gasdermin N端结构域在膜上形成的16元聚合体孔道;C. GSDMA3全长蛋白高分辨率晶体结构。
(供稿:王大成课题组)
附件下载: