阎锡蕴课题组在肿瘤体内成像领域取得新进展
2016年3月9日,《ACS nano》杂志在线发表了阎锡蕴课题组在肿瘤体内成像领域的最新成果。这是阎锡蕴课题组继发现纳米酶(NatureNanotechnology 2007)并将其应用于肿瘤体外诊断诊断(Nature Nanotechnology 2012)及体内药物靶向输送(PNAS 2014)之后,又一次将纳米材料的新特性应用到肿瘤体内成像诊断。
核医学(包括SPECT和PET)是目前灵敏度最高的功能学成像方法,但分辨率差(Typical Voxel/Piexel Dimension:12×12×12mm);磁共振(MRI)是目前分辨率最高的形态学成像方法(Typical Voxel/Piexel Dimension:1×1×1mm),但灵敏性差。因此,目前临床医学影像诊断的重大需求是如何将核医学与磁共振这两种信息互补成像手段相融合。尽管融合核医学与磁共振的影像整合机已经由 Philips、 Siemens、GE三家公司分别研制出来,美国FDA也已经批准这种整合机用于临床。然而,相应的分子探针的研发却相当缓慢,其主要原因是核医学与磁共振的灵敏度相差>106倍,很难通过一个探针实现病灶的核医学/磁共振双模成像。
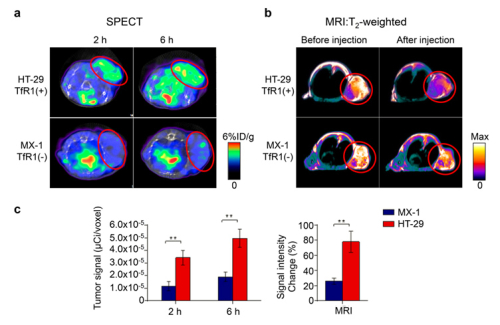
阎锡蕴课题组发明的新技术巧妙利用了人铁蛋白受体TfR1的快速肿瘤细胞循环内化特性,实现了肿瘤的核医学/磁共振双模成像。铁蛋白是人体内储存铁和维持人体铁代谢平衡的重要蛋白,它是由24个亚基自组装而成的笼状蛋白壳。阎锡蕴课题组在铁蛋白壳内部合成了氧化铁纳米颗粒,蛋白壳表面限量标记上放射核素,铁蛋白通过肿瘤高表达的受体TfR1的介导,快速循环内化进入到肿瘤细胞内部,将其所携带的铁纳米颗粒释放到肿瘤细胞内部,受体TfR1的不停循环内化使铁纳米颗粒高浓度富集于肿瘤内部,实现了肿瘤的高灵敏MRI对比造影。此外,由于放射核素的限量标记使得肿瘤摄取的放化剂量有限,因此,在同时实现MRI检测的同时又避免了由于放射核素的过量摄取造成的机体危害。因此,铁蛋白纳米探针解决了核医学与磁共振两种成像方式的巨大灵敏度差异,为体内肿瘤诊断提供了最高分辨率的形态学成像(磁共振)及最佳灵敏度的功能成像(核医学)。
文章链接 (ACS Nano, 2016, 10 (4), pp 4184–4191)
图1、纳米铁蛋白实现了体内肿瘤的核医学/磁共振双模成像。(a)肿瘤核医学成像;(b)肿瘤MRI成像;(c)定量肿瘤部位的核医学及磁共振信号。
(供稿:阎锡蕴课题组梁敏敏)
附件下载: