生物物理所柯莎研究组和陈畅研究组共同合作
2016年3月25日,《生物化学杂志》(JBC)在线发表了中科院生物物理研究所柯莎(Sarah Perrett)研究组和陈畅研究组的合作研究论文,题为“Glutathionylation of the Bacterial Hsp70 Chaperone DnaK Provides a Link Between Oxidative Stress and the Heat Shock Response”。该研究工作是柯莎研究组和陈畅研究组长期合作获得的重要成果。该研究揭示了氧化应激条件下发生的Hsp70的氧化还原修饰与氧化应激导致的热休克反应之间的联系,阐述了Hsp70的氧化还原修饰的氧化还原信号转导作用,发现在氧化应激条件下大肠杆菌的Hsp70(DnaK)发生谷胱甘肽化修饰后,与热休克反应因子σ32的相互作用减弱,导致σ32被释放,这可能是其促发热休克反应的机制之一。
蛋白质Cys的谷胱甘肽化修饰作为一种可逆的氧化还原修饰,意义之一在于保护蛋白免于发生磺酸化(-SO3H)等不可逆的氧化损伤,意义之二在于和磷酸化修饰一样发挥信号转导功能,传递氧化还原信号。Hsp70是蛋白质质量控制体系中的核心分子伴侣,对于生命体稳态平衡有极为重要的意义。除极少数Hsp70之外,大部分Hsp70都有至少1个Cys,可能作为氧化还原信号传递的媒介。目前已经报道了多种Hsp70的Cys的氧化还原修饰,包括谷胱甘肽化修饰。深入地挖掘Hsp70的氧化还原修饰相关的生理意义,将极大地拓展人们对Hsp70功能的认识。
该研究主要由柯莎课题组的副研究员张红(第一作者)、博士生杨杰、副研究员吴思和宫维斌等人完成相关实验,柯莎研究员和陈畅研究员为共同通讯作者。该研究得到了科技部973计划、自然基金委项目等的资助。
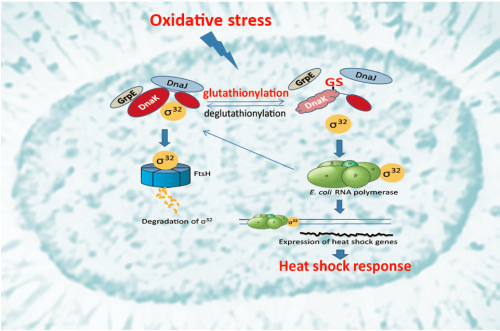
图解:E. coli热休克因子σ32是RNA聚合酶的亚基之一,调节热休克反应相关蛋白的表达,通过与Hsp70(DnaK),Hsp40(DnaJ)和核苷酸交换因子GrpE形成复合物导致其被蛋白酶FtsH降解,而降低细胞静息状态时的热休克反应水平。氧化应激条件下DnaK的谷胱甘肽化修饰,导致DnaK与DnaJ,GrpE和σ32的相互作用都显著减弱,它们所形成的复合物解体,释放σ32,从而促发热休克反应。
(供稿:柯莎课题组)
附件下载: