周政课题组在组蛋白变体的染色质组装机制研究中取得进展
为了被微小的细胞核空间所容纳,真核细胞的遗传物质DNA必须经历反复折叠,形成高度聚集的染色质;同时,为了确保各种基因表达调控因子与DNA进行相互作用,染色质也必须经常处于开放状态。要实现染色质结构的动态变化,细胞必须具有调节染色质结构的聚集和开放状态的能力。染色质的基本单位核小体由四种常规组蛋白H2A, H2B, H3, H4,以及长度为147 bp的DNA组成。染色质重构复合物SRCAP可以催化组蛋白变体H2A.Z对染色质中的H2A进行替换,造成染色质结构的改变。研究SRCAP催化的H2A.Z染色质组装对理解染色质结构的调控机制具有重要意义。
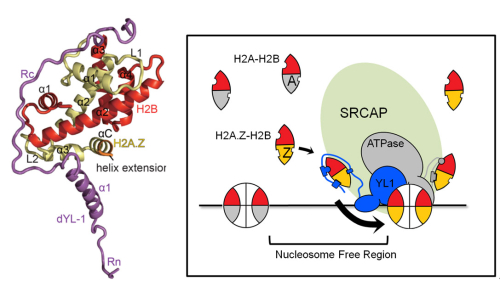
H2A的组蛋白变体具有多种类型,其中以对H2A.Z的研究最为深入。不同物种来源的H2A.Z与常规核小体H2A的序列相似性约为70%。H2A.Z与基因转录、基因沉默、异染色质建立、DNA损伤修复、基因组稳定性维持等生命进程以及疾病发生密切相关。哺乳动物的SRCAP复合物利用水解ATP产生的能量移除常规核小体中的H2A-H2B二聚体,同时将H2A.Z-H2B二聚体嵌入染色质,从而完成H2A.Z的染色质组装。SRCAP复合物的YL1亚基能够特异识别H2A.Z-H2B,并且是H2A.Z进行染色质组装必需的功能亚基。
2016年3月14日,国际期刊Nature Structural & Molecular Biology在线发表了中国科学院生物物理所周政课题组的研究论文“Structural basis of H2A.Z recognition by SRCAP chromatin remodelling subunit YL1”。该研究解析了YL1与组蛋白变体H2A.Z-H2B二聚体形成的三元复合物的1.9-?分辨率晶体结构。通过生物化学、生物物理、酵母遗传学等多种方法,研究人员证明H2A.Z的C端序列中与常规核小体不同的3个氨基酸残基是YL1-Z对其进行优先识别的决定因素。本研究揭示了一种全新的H2A.Z特异识别机制并探讨了H2A.Z的传递机制。
该研究获得国家自然科学基金和科技部973计划的资助。美国霍华德休斯医学研究所Janelia研究中心的Carl Wu研究员参与了该课题的研究,生物物理所表观遗传团队的其他成员在研究过程中提供了重要帮助。
图示:YL1-Z-H2A.Z-H2B的复合物结构(左图)以及SRCAP复合物对H2A.Z-H2B二聚体进行识别和传递的基本模型示意图(右图)。
(供稿:周政课题组)
附件下载: