黄亿华课题组在β-桶状膜蛋白插膜生成机理方面取得重要进展
整合膜蛋白主要分为两个基本的大类:α-螺旋膜蛋白和β-桶状膜蛋白。β-桶状膜蛋白主要分布于线粒体、叶绿体以及革兰氏阴性细菌的外膜内, 行使许多重要的生物学功能。在革兰氏阴性细菌中, 细菌外膜内的各种新生β-桶状膜蛋白由一个定位于外膜的BAM复合体负责插膜生成。因此, BAM复合体为革兰氏阴性细菌的存活所必需, 也是重要的新型抗生素靶点。完整的BAM复合体由BamA、BamB、BamC、BamD和BamE五个亚基组成,分子量约为200 KD。但BAM复合体如何组装以及如何行使插膜功能尚不清楚。
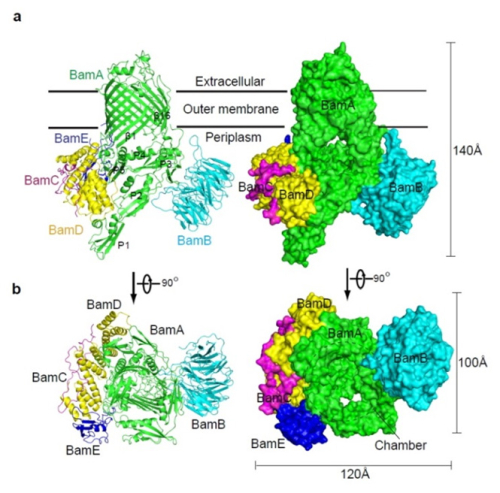
2016年2月22日,《Nature》 杂志子刊 《Nature Structural & Molecular Biology》在线发表了中国科学院生物物理所黄亿华课题组的研究论文 (“Structure of the BAM complex and its implications for biogenesis of outer-membrane proteins.”)。该项研究首次解析了BAM 蛋白复合体完整的晶体结构,发现其形成一个类似于 “帽子”状的结构:BamA的跨膜区由16条β-链围成,形成“帽冠”镶嵌于外膜内,而组成BamA的5个POTRA(polypeptide transport-associated)结构域则在周质内中和四个脂蛋白BamB,BamC, BamD及BamE相互结合形成“帽沿”。这种构象能够能为分子伴侣-新生β-桶状膜蛋白底物复合体提供结合位点。结构分析和功能实验进一步揭示了BAM复合体中各个组分之间的相互作用以及潜在的底物插入外膜出口,初步揭示了BAM复合体介导的细菌外膜内新生β-桶状膜蛋白的插膜生成机理。
本研究工作得到了科技部973计划,国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助。
图示:BAM复合体的整体结构。
(供稿:黄亿华课题组)
附件下载: