
张宏课题组与日本科学家合作发现线虫
2015年12月17日,中科院生物物理所的张宏研究员课题组和日本微生物化学所的Nobuo N. Noda研究员课题组合作,在国际著名刊物 Molecular Cell 杂志上,在线发表了题为“Structural basis of the differential function of the two C. elegans Atg8 homologs, LGG-1 and LGG-2, in autophagy”的研究论文,揭示了线虫中两个Atg8的同源基因LGG-1和LGG-2在蛋白聚集体自噬降解中的不同功能。
细胞自噬(autophagy)是一种自噬小体介导的细胞降解途径。自噬过程包括自噬小体的形成、延伸、闭合以及与溶酶体的融合。目前研究发现,自噬可以选择性的识辨并降解蛋白聚集体。ATG8-PE 泛素系统在自噬小体的形成过程中具有核心的作用。ATG8-PE可以与自噬受体蛋白(如p62和NBR1)相互作用,进而招募特异降解的蛋白底物。高等动物中的自噬过程比单细胞酵母中要复杂的多,一方面是由于酵母中的一个自噬基因在高等动物中有多个同源基因发挥类似的功能,另一方面是由于高等动物又进化出了一系列特异的自噬基因,如张宏研究员课题组前期鉴定的EPG基因。多细胞生物至少存在着七个酵母ATG8基因的同源物,都属于LC3 和 GABARAP/GATE-16家族蛋白。但它们在不同的发育时期参与细胞自噬各阶段的功能仍然未知。
在此研究中,张宏研究员等对线虫中两个Atg8的同源基因LGG-1和LGG-2进行了结构和功能上的研究。不同于lgg-1在蛋白聚集体自噬过程中的不可或缺,lgg-2表现出了不同降解底物的特异性和不同发育阶段的特异性。LGG-1和LGG-2可以与不同的细胞自噬底物和自噬蛋白相互作用,这些互作蛋白几乎都含有LIR motif。基于LGG-1和LGG-2结构的差异,它们对不同类型的LIR motif存在特异的偏向性,并确保了自噬蛋白被招募的先后顺序,进而决定了它们在自噬降解作用的不同步骤发挥作用。
LGG-1和LGG-2有两个疏水口袋,W位点和L位点,这两个位点可以识别Atg8结合蛋白的LIR结构域。通过对比,张宏研究员等发现,LGG-1和LGG-2 的W位点和L位点有显著差异,它们识别不同的LIR结构域,进而结合不同的Atg8结合蛋白。他们还发现 LGG-1和LGG-2的氨基端分别呈现闭合构象和开放构象,氨基端的差别也导致了它们在介导膜锚定和膜融合上的活性差异。
lgg-1 和lgg-2在自噬过程中的功能差异,为科学家研究哺乳动物细胞中GABARAP和LC3 家族蛋白在自噬通路中功能的异同提供了线索。以往人们认为参与自噬作用的同源基因参与不同自噬底物的降解。但张宏研究员等的研究表明,多细胞生物中,自噬基因还会表现出不同降解底物的特异性和不同发育阶段的特异性。
张宏研究员和Nobuo N. Noda研究员是本文的通讯作者。张宏课题组的吴凡博士完成了本课题的大部分工作;Noda课题组的Yasunori Watanabe博士和冯巍课题组的博士生齐欣解析了多个LGG-1和LGG-2的晶体结构;胡俊杰课题组的博士生郭向阳完成了膜锚定和融合的实验;他们被列为共同第一作者。该项目得到了国家自然科学基金、科技部重大科学研究计划、日本优先领域科学研究资助项目,此外本研究还得到霍华德?休斯医学研究所青年科学家奖的资助。
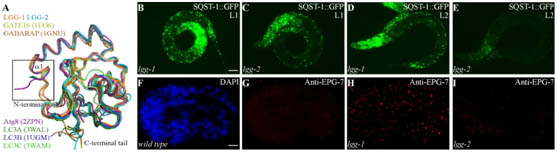
图例:LGG-1和LGG-2在结构上的差异以及lgg-2表现出了降解底物特异性和发育阶段特异性
(供稿:张宏课题组)
附件下载: