饶子和、胡俊杰课题组
细胞内膜的膜融合是维持生命活动正常发生的重要过程。之前对于膜融合的研究主要集中在不同膜之间的融合,主要的研究对象有SNARE介导的囊泡融合。而内质网、线粒体等关键细胞器的同源膜融合还研究得很少。
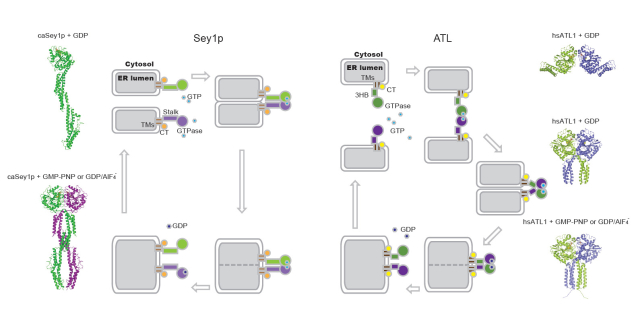
内质网膜融合的缺陷在人体内会导致一种遗传性痉挛性截瘫。中国科学院生物物理所胡俊杰课题组以及其他国外课题组前期的系列研究揭示了atlastin(ATL)家族介导内质网膜融合的分子机制。但不是所有的真核细胞都表达ATL,在植物和酵母中另一系列的嵌膜GTP酶Sey1p和RHD3负责完成内质网的融合。虽然功能相似,但Sey1p等蛋白要比ATL长很多,且在内质网上的定位也不尽相同,预示着作用机制上的不同。
最近,饶子和院士课题组与胡俊杰课题组合作,阐释了酵母内质网融合因子Sey1p的作用机制。该工作展示了Sey1p与之前报道的dynamin超家族成员不一样的构象,并与其哺乳动物同源蛋白ATL作用机理进行了比较,拓宽了对膜动态变化机制的了解。
饶子和课题组成功解析了白色念珠菌Sey1p结合不同GTP类似物的结构,胡俊杰课题组进一步从生化和细胞层面测试了Sey1p的功能,发现Sey1p和ATL介导融合的步骤虽相似,但构象变化发生在不同的节点。Sey1p可以在不水解GTP的情况下介导融合,但在有GTP的条件下融合效率更高。另外,Sey1p在细胞中的点状分布与其酶活相关。
该成果于2015年9月14日在线发表在细胞生物学的高水平杂志Journal of Cell Biology上。该研究得到国家自然科学基金和国家基础研究计划的支持,胡俊杰也得到霍华德休斯医学研究所(HHMI)国际青年科学家基金得支持。饶子和、娄智勇课题组的闫利明和胡俊杰课题组的孙厦为共同第一作者。
此外,由于其在内质网融合领域的贡献,胡俊杰也于近期接受了Journal of Cell Biology “People & Ideas”专栏的采访报道。(更多内容请见:http://intl-jcb.rupress.org/content/209/5/626.full )
图示: Sey1p和ATL介导的膜融合模型。左侧为本项工作解析的Sey1p结构,右侧为此前解析的ATL结构。
(供稿:胡俊杰课题组)
附件下载: