
王江云研究组在氧化酶设计与功能研究方面获得新进展
2015年4月13日,王江云研究组与美国伊利诺伊大学香槟分校Yi Lu课题组合作,在化学一流杂志Chemical Science发表了题为“Significant Improvement of Oxidase Activity through the Genetic Incorporation of a Redox-active Unnatural Amino Acid”的最新研究成果。该研究通过基因编码的方法将具有较低氧化还原电势的酪氨酸类似物引入基于肌红蛋白的氧化酶,通过酶活的升高,揭示了酪氨酸氧化还原电势调节对氧化酶酶活的影响。
作为具有氧化还原活性的氨基酸,酪氨酸出现在很多酶的活性中心,直接参与酶促反应。自然界运用了多种翻译后修饰,精确调节酪氨酸的各种性质以适应相应酶促反应的要求。血红素-铜氧化酶是一类在呼吸链末端高效催化氧气还原为水的金属蛋白酶。在这类酶的活性中心有一个保守的酪氨酸,与附近的组氨酸交联,改变了它的pKa和氧化还原电势。在之前引入一系列具有不同pKa的酪氨酸类似物的基础上,我们发展了通过基因编码的方法引入3-甲氧基酪氨酸(OMeY)的体系,并实现通过酪氨酸裂解酶生物转化合成这一氨基酸。将OMeY引入基于肌红蛋白的氧化酶的活性中心后,其氧化酶酶活增加到了原来的三倍,产生的自由基中间体也大大减少。 由于OMeY的氧化还原电势比酪氨酸低179mV,而pKa近似,含OMeY突变体的酶活增加说明了酪氨酸的氧化还原电势调节在氧化酶中非常重要。这一研究直接证明了酪氨酸氧化还原电势与反应活性的联系,并提供了通过非天然氨基酸的插入提高酶活的方法,为金属蛋白的理性设计方面提供了新的研究工具。
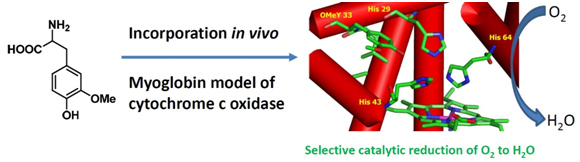
图、通过非天然氨基酸研究氧化酶的酶活与酪氨酸氧化还原电势的关系。
该研究得到科技部国家重点基础研究973计划和国家自然科学基金委员会的资助。
全文链接:
http://pubs.rsc.org/en/content/articlelanding/2015/sc/c5sc01126d
(供稿:王江云课题组)
附件下载: