王艳丽研究组在Nature杂志上发表
2014年8月12日,Nature杂志在线发表了中科院生物物理研究所王艳丽研究组关于CRISPR系统中Cascade复合物的研究进展,标题为“Crystal structure of the RNA-guided immune surveillance Cascade complex in Escherichia coli”。本文揭示了Cascade的晶体结构及其与RNA相互作用的方式。
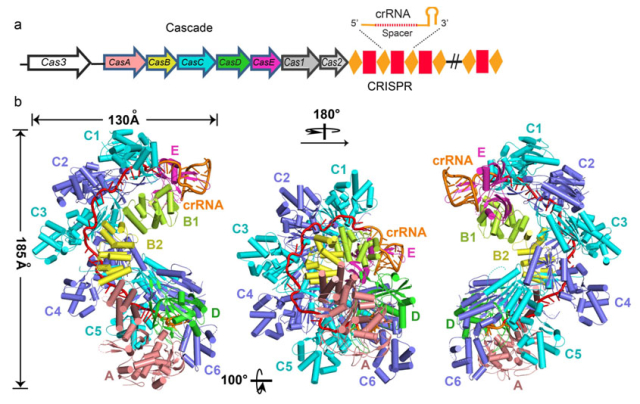
成簇的、有规律间隔的短回文重复序列(clustered regularly interspaeed short palindromic repeats,CRISPR)和它的辅助蛋白(CRISPR-associated, Cas)构成CRISPR/Cas系统,以一种类似于真核生物RNA干扰(RNAi)的作用机制,在原核生物抵抗入侵的噬菌体和质粒的防御系统中发挥着重要作用。CRISPR-Cas系统分为三个类型(I型,II型和III型),大肠杆菌CRISPR/Cas 系统属于I-E型,由5种Cas蛋白组成的11个亚基(其中含有1个CasA,2个CasB,6个CasC,1个CasD和1个CasE)以及一段61个核苷酸的成熟crRNA(CRISPR RNA)组成Cascade(CRISPR-associated complex for antiviral defense)复合物。Cascade复合物的质量约为405kDa,外观上呈现出近似于“海马”的结构,王艳丽研究组通过深入研究,获得了分辨率为3.05 ?的X射线晶体结构,详见下图:
该结构显示,61个核苷酸的crRNA横跨Cascade的11个亚基,并与6个CasC亚基相互作用,5’和3’末端分别被CasD和CasE锚定。CrRNA的间隔区序列定位在CasC1-6亚基形成的连续的沟槽中。来自CasC2-6的5个长β发卡结构穿过crRNA。因此crRNA被分成5个片断,每个片段包括5个堆叠的碱基和一个翻转的碱基。每一个crRNA间隔区片断通过相似的方式与CasC相互作用。进一步的研究显示,crRNA不仅在靶点识别中发挥重要作用,而且也在Cascade的组装中发挥重要作用。本研究为Cascade如何发挥功能提供了重要依据。
王艳丽研究组的博士生赵宏图为本文的第一作者,该研究得到科技部、国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助,上海光源为该研究提供了重要的技术支持。
文章链接:http://www.nature.com/nature/journal/vnfv/ncurrent/full/nature13733.html
(供稿:王艳丽课题组)
附件下载: