范祖森课题组在Pcid2蛋白调控胚胎干细胞
近日,干细胞研究权威期刊Stem Cells杂志在线发表了中科院生物物理研究所范祖森课题组题为“Pcid2 Inactivates Developmental Genes in Human and Mouse Embryonic Stem Cells to Sustain Their Pluripotency by Modulation of EID1 Stability.”的研究论文,揭示了Pcid2蛋白调控胚胎干细胞(ES细胞)多能性维持的分子机制。
ES细胞自我更新由全能性相关基因的表达和分化相关基因的关闭实现,而ES细胞的分化则对应着特异转录因子的激活,谱系特异基因的上调表达及全能性基因的表达抑制。对胚胎干细胞自我更新与分化的命运转换调控机制目前阐释的并不清楚。已有的研究表明表观遗传机制在胚胎发育及干细胞分化等生理过程中发挥重要的调控作用。其中,CBP/p300蛋白复合体作为组蛋白乙酰转移酶及转录共激活因子,在胚胎发育、转录调控及胚胎干细胞分化中发挥关键作用。Pcid2是酵母中调控mRNA出核转运相关复合体中Thp1的同源蛋白,Thp1参与mRNA的转运调控。通过全基因组RNAi筛选,表明Pcid2在小鼠ES细胞干性维持中发挥作用,然而,其作用机制尚未阐述。
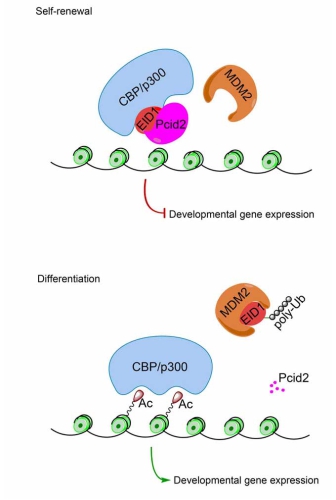
范祖森课题组研究发现,Pcid2基因敲除导致人和小鼠ES细胞失去干性,在体内失去三胚层分化能力。并且Pcid2基因敲除导致胚胎不能发育至囊胚期。该课题组进一步证实了Pcid2通过抑制ES细胞分化基因的表达而维持ES细胞的干性。通过酵母双杂交筛选和免疫共沉淀等实验体系,发现CBP/p300乙酰转移酶活抑制因子EID1与Pcid2相互作用,并共存在于CBP/p300复合体中。该课题组进一步研究发现,Pcid2与E3泛素连接酶MDM2竞争性结合EID1,抑制EID1的降解过程,阻断CBP/p300的乙酰转移酶活性和分化相关基因启动子区H3组蛋白Lys9及Lys14位乙酰化修饰,从而抑制ES细胞分化相关基因的表达。综上所述,Pcid2通过调控EID1的蛋白稳定性,抑制人及小鼠ES细胞发育相关基因表达,在ES细胞自我更新与分化的调控中发挥重要作用。该研究为理解ES细胞重编程机制提供了重要依据。
范祖森课题组的副研究员叶步青和助理研究员戴中华为本文的共同第一作者。该工作得到了国家自然基金委、科技部、中科院干细胞先导专项和中国博士后基金的资金资助。
图示:Pcid2蛋白调控胚胎干细胞多能性维持机制的工作模型
文章链接:http://dx.doi.org/10.1002/stem.1580.
Ye B1, Dai Z, Liu B, Wang R, Li C, Huang G, Wang S, Xia P, Yang X, Kuwahara K, Sakaguchi N, Fan Z. Pcid2 Inactivates Developmental Genes in Human and Mouse Embryonic Stem Cells to Sustain Their Pluripotency by Modulation of EID1 Stability. Stem Cells. 2014 Mar;32(3):623-35. doi: 10.1002/stem.1580.
(供稿:范祖森课题组)
附件下载: