刘志杰课题组在《Cell Res》杂志发表TLR9依赖的
2014年1月10日,刘志杰课题组在《Cell Res》杂志在线发表题为“Structural analysis of asparaginyl endopeptidase reveals the activation mechanism and a reversible intermediate maturation stage”的研究论文,揭示天然免疫系统识别DNA信号通路中TLR9的激活关键酶AEP结构与功能。
天冬酰胺内肽酶(asparaginyl endopeptidase, AEP),又名Legumain (EC 3.4.22.34),是一种溶酶体半胱氨酸内肽酶,能够特异性水解天冬酰胺残基羧基端肽键,也能够对天冬氨酸残基羧基端肽键进行水解。AEP存在于多种哺乳动物组织中,如肾,胎盘,脾,肝和睾丸等,主要定位于溶酶体。该酶属于半胱氨酸蛋白酶C13家族,活性可以被体内天然存在的抑制剂cystatin C抑制,也能被碘乙酰胺及马来酰亚胺等抑制。
AEP在溶酶体降解系统中发挥重要作用,若AEP缺失将引起组织蛋白酶B, H及L的前体聚集并且产生噬血细胞综合症。AEP最初是作为一个加工抗原及自身抗原的重要酶出现,如它能够加工破伤风毒素,髓磷脂碱性蛋白,α-thymosin及其它抗原等。AEP在肿瘤细胞中高表达,对于肿瘤的侵袭和迁移具有重要作用。AEP还通过参与Toll样受体(TLR)3,7和9的成熟而调控起始免疫应答。同时它还能够抑制破骨细胞的形成及骨吸收,并且在动脉粥样硬化及中风中发挥作用。最新研究表明,AEP还可以作为人乳腺癌诊断和预测的一个指标。同时,AEP在植物中还能够介导肽主链的环化。
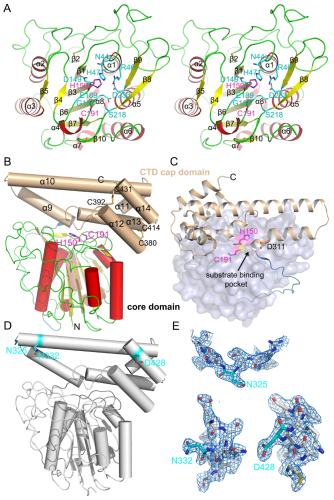
人源AEP由433个氨基酸残基组成,带有一个信号肽。由于存在糖基化修饰,分子量约为56 kDa。AEP在溶酶体中活化时,需切除N端(D21或D25位)及C端(N323)的两个多肽,产生46 kDa的活性形式,并进一步被加工为36 kDa。Dall等人发现存在另外两个切割位点:D303和D309。在这些位点切割后,AEP成为超级活化状态。 本课题以AEP为研究对象,结构生物学为主要研究手段,通过获得AEP非活化、活化状态及其分别与抑制剂、底物类似物复合物的精细三维结构,结合酶活性分析来阐明AEP自活化及催化底物的分子机制。
我们首先获得了鼠源AEP非活化状态的晶体结构,由于AEP的自我活化过程是pH依赖的。我们期望同时获得AEP在pH 4.5以及pH 3.5不同活化状态下的晶体结构。结构比对显示,pH 3.5时AEP的晶体结构与非活化状态下的结构相比,少了帽子部分。而pH 4.5时AEP的晶体结构与非活化状态下的晶体结构完全相同。SDS-PAGE分析及N端测序结果显示,AEP在pH 4.5时,N325,N332和D428三处的肽键是断裂的。而在pH 4.5的AEP晶体结构中,三处的电子密度图是完好且连续的。由于pH 4.5时的AEP结晶条件是pH 8.5,因此我们意外地发现,pH 4.5时的AEP通过改变pH至中性值可以变回非活化状态(图1)。
图1:AEP的晶体结构
在制备AEP与Cystatin C复合物时,发现两者在pH 7.5以及pH 4.5时均不能形成复合物。而两者在pH 3.5时,Cystatin C则被AEP降解。进一步的研究我们发现Cystatin C是通过竞争AEP的活性位点来抑制AEP切割活性。
本研究成果由刘志杰课题组和UCLA程根宏教授合作完成。美国艾默利大学医学院(Emory University School of Medicine)的Keqiang Ye教授,清华大学化学系刘磊教授,上海科技大学黄蔚教授,美国洛斯阿拉莫斯国家实验室(Los Alamos National Laboratory)Li-Wei Hung教授等提供了帮助。
该研究得到国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项、科技部973和国家自然科学基金委的资助。
全文链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr20144a.html
(供稿:刘志杰课题组)
附件下载: