NSMB发表许瑞明课题组“核小体与蛋白质识别”最新研究成果
2013年8 月11日,Nature structural & Molecular Biology 在线发表了生物大分子国家重点实验室许瑞明课题组的最新研究成果。该文章题为:“Nα-acetylated Sir3 stabilizes the conformation of a nucleosome-binding loop in the BAH domain”,揭示了N端乙酰化修饰促进Sir3的转录沉默功能以及提高与核小体间相互作用的分子机理。
核小体是真核生物染色质的基本结构单元,是由约146 bp的DNA缠绕在核心组蛋白八聚体上形成的直径为11 nm的盘状结构。关于核小体的组装、修饰及识别是表观遗传学的重要研究内容。但关于蛋白质与核小体复合体的晶体结构解析仍然是当今研究难点。此项研究选取了酵母中参与基因表达沉默的Sir3蛋白,通过其N-端BAH结构域与核小体复合体的晶体结构解析,定量地分析了N-端乙酰化修饰对Sir3蛋白与核小体相互作用的影响,进而提高了对其基因沉默功能调控的认识。
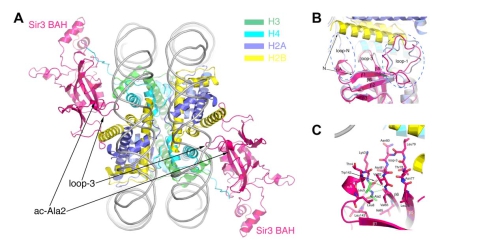
酵母的交配型区(HM loci)及端粒区域是基因表达沉默的异染色质区域。一系列Sir(Silent Information Regulator)蛋白在这些区域的基因沉默中发挥重要的作用。其中Sir3蛋白通过其N端BAH (Bromo Adjacent Homology)结构域与核小体及Sir1的识别,促进Sir3-Sir4-Sir2复合体参与的异染色质建立,导致HM等区域的基因表达沉默。已知Sir3蛋白的N端乙酰化修饰可加强其与核小体的识别,对其基因沉默的功能至关重要。我们成功表达了带N端乙酰化修饰的Sir3BAH蛋白,体外重构了酵母核小体核心颗粒(yNCP),通过体外等温滴定实验证明了N-端乙酰化修饰显著提高了Sir3BAH与核小体的结合能力。解析了ac-Sir3BAH-yNCP复合体及单独ac-Sir3BAH的晶体结构。结构表明,一个NCP对称结合了两个ac-Sir3BAH蛋白。Nα乙酰化的Ala2残基并不直接与核小体相互作用,而是折回了Sir3本身的一个疏水口袋,并通过与Loop-3的相互作用,稳定了Loop-3,并使其处于一种更利于核小体结合的构象。该研究揭示了N端乙酰化修饰调节Sir3与核小体相互作用的结构机理,为真核生物普遍存在的蛋白质N段乙酰化修饰所蕴含的生物学意义给出了一个很好的阐释。
图注:A) N端乙酰化的Sir3BAH与酵母NCP复合体的晶体结构示意图;B) ac-Sir3BAH-yNCP与Sir3BAH-xNCP结构比对图,可见N末端Ala2残基及Loop3部位的差别;C) Nα乙酰化修饰的Ala2残基折回了Sir3本身的疏水口袋,并通过相互作用稳定了Loop3。
该项研究工作得到科技部、国家自然科学基金委员会和中国科学院的资助。
全文链接:http://www.nature.com/nsmb/journal/vaop/ncurrent/pdf/nsmb.2637.pdf
(供稿:许瑞明课题组)
附件下载: