刘迎芳课题组在抗病毒蛋白结构与功能研究方面取得新进展
2013年6月18日,《Cell Research》杂志在线发表了生物物理所刘迎芳课题组的研究成果,题为“Crystal structure and nucleotide selectivity of human IFIT5/ISG58”。该项成果是刘迎芳课题组继抗病毒蛋白ISG54(Cell Research. 2012 Sep;22(9):1328-38.)研究工作之后,在ISG56家族蛋白结构与功能研究方面的新进展。
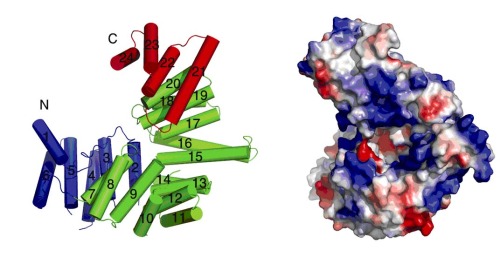
虽然同属于一个家族,相比较ISG54和ISG56,关于ISG58的功能研究很少。以往的实验结果表明ISG58可能具有核酸结合能力并参与抗病毒的免疫应答过程。我们通过解析ISG58的晶体结构,发现ISG58由24个串联的α螺旋构成,其中3-24个螺旋组成11个TPR结构域,整体折叠成“V”字形结构。通过分析ISG58的表面电荷分布情况,我们发现其“V”形结构中心是一个富含正电荷的孔洞。由于其同家族蛋白ISG54通过该区域结合RNA,而且其RNA结合能力对其发挥抗病毒活性是必需的,因此我们推测ISG58很有可能也通过该区域结合核酸。我们设计了不同序列和长度的单链、双链的DNA和RNA,通过凝胶迁移实验(EMSA)研究了ISG58对核酸序列的选择性。EMSA的结果显示:ISG58和ISG54不同,它倾向于结合不同长度的单链RNA和双链DNA片段。相比较ISG54和ISG56以二体或者寡聚形式存在,ISG58在溶液中以单体形式存在,ISG58结合单链RNA后仍为单体形式。经过突变实验发现,ISG58结合核酸的位点位于自身形成的孔洞。如果将“V”形结构中心的正电荷残基突变成带相反电性的谷氨酸,其核酸结合能力和抗病毒能力均大大降低,因此我们推测ISG58抗病毒活性依赖于其结合核酸的能力。
我们的工作将为揭示ISG56家族蛋白的免疫学分子机制研究提供起点和基础。在文章审稿的过程中,国际上其他研究小组先后在Nature和Molecular Cell上发表了类似的工作。该项工作得到了国家自然基金委的资助。
文章链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201380a.html
(供稿:刘迎芳课题组)
附件下载: