细胞极化因子Par-3组装机理得到阐释
2013年6月4日,国际知名杂志《Structure》在其最新的一期上发表了中国科学院生物大分子国家重点实验室冯巍研究员与孙飞研究员合作完成的一项研究成果(http://www.cell.com/structure/abstract/S0969-2126(13)00114-7)。该项研究成果综合了蛋白质晶体学,低温电镜三维重构技术,原子力显微镜,以及分子动力学模拟,深入系统的研究了细胞极化发生因子Par-3 N-端结构域自组装的分子机理。研究发现,Par-3 N-端结构域通过静电相互作用形成首尾相接,螺旋上升的组装结构。对相互作用面上的静电相互作用的破坏,使得Par-3失去了调控极性的功能。该项研究成果为综合多种研究手段解析生物大分子复合物的结构提供了一个新的范例。
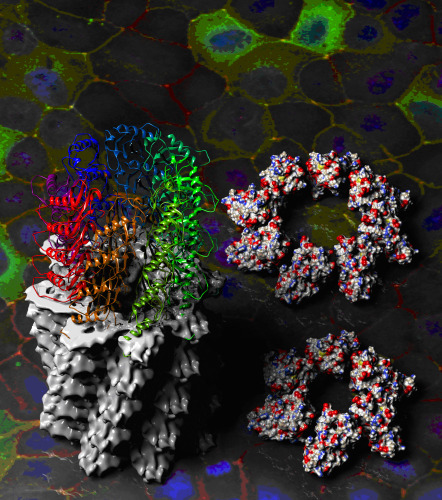
图一:显示Par-3的N端结构域的螺旋组装结构和其基本的通过静电相互作用首位相接的组装形式,背景显示的是Par-3介导的细胞极化现象。
Par-3在调控各类不同物种的细胞极性方面起到基础性的作用。有研究表明Par-3在体内可以多聚化。已知Par-3蛋白质包含NTD,PDZ和aPKC结合域等结构域。其中NTD结构域的高聚化对于介导Par-3的聚集起到不可或缺的重要作用。关于Par-3 N-端结构域高聚的分子机理,一直没有得到详尽剖析。冯巍课题组与孙飞课题组合作完成的该项研究成果给该问题画上了句号。
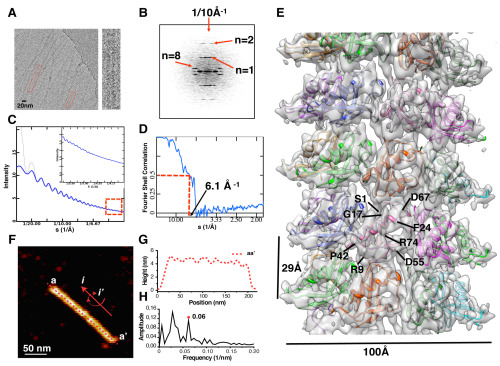
图二:显示通过低温电镜三维重构技术和原子力显微技术获得Par-3的N端结构域螺旋组装体的高分辨率结构。
该项研究成果的核心部分Par-3 NTD的螺旋组装体的高分辨率低温电镜三维重构研究工作是由孙飞课题组的张艳助理研究员完成的。这也是我国首次利用低温电镜技术解析的螺旋结构样品的高分辨率结构。此外,冯巍课题组的王文娟同学完成了生物化学方面的工作,并在龚为民课题组高峰博士的帮助下完成了蛋白质晶体学方面的工作。原子力显微镜部分的工作是与丹麦Aarhus大学iNANO中心的董明东教授和Besenbacher Flemming教授合作完成的。细胞功能实验方面的工作得到了香港科技大学张明杰教授的帮助。
以上工作得到了国家重大基础研究计划,国家自然科学基金委的资助。
(供稿:冯巍课题组、孙飞课题组)
附件下载: