《Cell Research》发表刘志杰课题组
近日,自然出版集团旗下的《Cell Research》在线发表了中国科学院生物物理研究所刘志杰课题组题为“Structural basis for termination of AIM2-mediated signaling by p202”的研究成果,阐述了天然免疫信号传导重要蛋白p202抑制AIM2介导的炎症小体信号通路的结构基础。
真核生物的天然免疫(又称固有免疫或非特异性免疫)反应(innate immune response),发生于系统发育的早期和抗感染应答的初期阶段。是机体抵抗病原微生物入侵、保护自身的第一道屏障。天然免疫系统一方面通过炎症反应等机制直接清除感染,另一方面也可以通过诱导获得性免疫(adaptive immunity)系统的活化,进而激发更加高效和特异性的免疫应答。天然免疫系统通过机体的模式识别受体(pattern-recognition receptors, PRRs)对入侵微生物中高度保守的“分子标签”(molecular signature)——病原相关分子模式(pathogen-associated molecular patterns,PAMPs)进行特异性识别,从而感知细菌、病毒等外来微生物入侵并激活不同的胞内信号通路和基因表达,启动机体免疫反应。因此,了解机体免疫系统对病原微生物分子模式,如核酸等的识别和检测是天然免疫研究的重要内容。
到目前为止,研究人员已鉴定了多种胞质内模式识别受体之一的DNA感受因子(DNA sensor),如AIM2、DAI/ZBP-1、RNA聚合酶III(RNA polymerase III)、IFI16、DDX41、DNA-PKC、cGAS等。其中AIM2(absent in melanoma 2)是PHYIN蛋白家族成员。PHYIN蛋白家族又称为HIN-200蛋白家族(The interferon-inducible p200-protein)。迄今已经鉴定出人源的4种成员:IFI16、MNDA、AIM2和IFIX蛋白,小鼠的5种成员:p202、p203、p204(对应人IFI16)、p205和p210(对应人AIM2)蛋白。AIM2主要定位于胞质内,N端含一个PYD结构域(pyrin domain),C端为HIN-200结构域。N端和C端结构域可相互作用形成非活化的AIM2。当AIM2的HIN-200结构域在胞质内结合双链DNA后,释放PYD而招募接头蛋白ASC(Apoptosis-associated speck-like protein containing a caspase recruitment domain),并诱导了炎性小体(Inflammasome)的组装,从而引起Caspase-1的激活以及IL-1β和IL-18的成熟和分泌,导致细胞焦亡(Pyroptosis)。AIM2作为胞质内双链DNA感受因子对天然免疫系统的认识和自身免疫性疾病(如系统性红斑狼疮等)的新型治疗药物的研发具有重要意义。HIN-200蛋白家族的成员p202,和AIM2一样可以与双链DNA结合,有趣的是AIM2可以促进Caspase的活化,而p202却抑制AIM2的作用。
继2012年刘志杰课题组在重要天然免疫系统信号分子STING结构与功能研究获得突破后,本研究是对该天然免疫信号系统上游病原DNA识别机制的深入探索。该团队联合美国UCLA程根宏教授课题组,综合运用了X-射线晶体学、生物化学、细胞生物学和生物物理学方法,解析了AIM2与DNA的复合物,阐明其通过分子排挤模式(crowding model)产生炎性因子。同时,解析了p202与DNA的复合物,结合结构分析和相关的功能实验,本研究阐明了p202抑制AIM2介导的炎症小体信号通路的结构基础和分子机制。
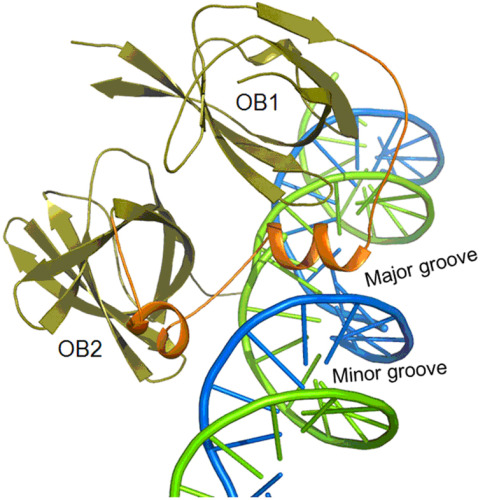
图1 AIM2 HIN结构域与DNA的复合物结构
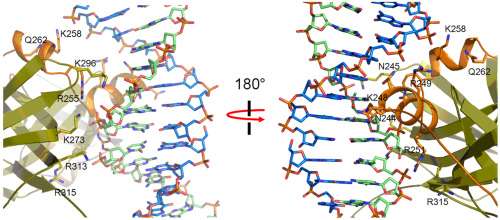
图2 AIM2 HIN结构域与DNA的相互作用
该项研究是刘志杰课题组和美国UCLA程根宏教授课题组合作完成的又一项研究成果。该研究得到了国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项、国家自然科学基金委和科技部973项目的资助。
文章链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201352a.html
(供稿:刘志杰课题组)
附件下载: