《Immunity》发表生物物理所刘志杰课题组及合作者
2012年5月10日,国际著名免疫学杂志《Immunity》在线发表了中国科学院生物物理研究所刘志杰、程根宏(海外团队)、张荣光课题组在重要天然免疫系统信号分子STING结构与功能研究方面的合作研究成果,该论文题为“Structural Analysis of the STING Adaptor Protein Reveals a Hydrophobic Dimer Interface and Mode of Cyclic di-GMP Binding”(DOI:10.1016/j.immuni.2012.03.019)。
天然免疫反应是机体抵抗病原体入侵、保护自身的第一道防线。自2008年以来,关于干扰素刺激因子STING(STimulator of INterferon Genes,又名MITA,ERIS或MPYS)通过引起I型干扰素的产生激发机体天然免疫反应的一系列研究引起了人们的广泛关注。美国迈阿密大学医学院癌症研究中心的Glen N. Barber课题组分别于2008年10月和2009年10月在Nature上报导称,新发现的STING是启动机体天然免疫系统抵抗细菌或病毒感染的重要分子。武汉大学舒红兵院士课题组发现,STING作为天然免疫抗病毒信号接头分子将病毒感知受体和IRF3激活、I型干扰素产生联系起来。后来的研究还发现E3泛素连接酶RNF5与STING相互作用,并负调节病毒触发的下游信号通路。北京大学蒋争凡教授课题组报道了STING引起I型干扰素产生的信号通路激活需要STING二聚化。他们还发现了一条通过STING-TBK1活化转录因子STAT6,从而连接天然免疫与适应性免疫的信号传导通路,为人们进一步认识免疫系统如何防御病原微生物感染的机制提供了新思路。2010年日本学者Akira课题组发表文章称TRIM56与STING相互作用并泛素化STING K150位点。该泛素化修饰诱导STING二聚化,而二聚化又是STING募集TBK1、引起干扰素产生的前提条件。然而,该研究不能解释胞质内的TRIM56蛋白是如何实现跨膜(因为153-173肽段是预测的最后一个跨膜区)泛素化STING K150位点。去年9月,Burdette等人发现,STING在病原菌和病毒感染时角色不同:既是病原菌所分泌的第二信使cyclic di-GMP(c-di-GMP)的感受因子(sensor),又是宿主感知病毒核酸产生I型干扰素反应的信号接头分子(adaptor)。该研究发表在Nature上,引起天然免疫领域学者的广泛关注。总之,近年来有关STING的大量研究报导表明了该分子在天然免疫信号通路中的重要性。同时,不同课题组间某些研究结果的不一致性更加激发了人们对STING进行更深入探讨的热情。
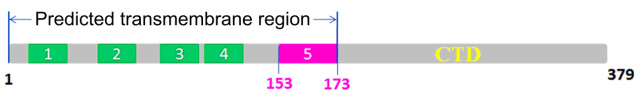
STING蛋白包含一个预测的N端五次(有的文献认为四次)跨膜部分(1-173aa)和C端胞内可溶部分(174-379aa),如图1所示。有关N端的功能目前仍不清楚,但和其在细胞内定位有关。C端胞内结构域(C-terminal domain, CTD)可通过募集相互作用分子而行使重要功能。STING氨基酸序列与PDB中任何已知结构的蛋白质没有同源性,预示它可能拥有独特的三维结构。此外,到目前为止,仍有许多关键科学问题悬而未决,如STING激活TBK1-IRF3信号通路的分子机制,TRIM56如何实现跨膜泛素化STING K150的,STING是如何结合c-di-GMP的?针对以上问题,我们开展了针对STING CTD的结构生物学和细胞生物学研究。
图1:STING全长的二级结构组织模式。它包含N端跨膜区和C端可溶结构域CTD。
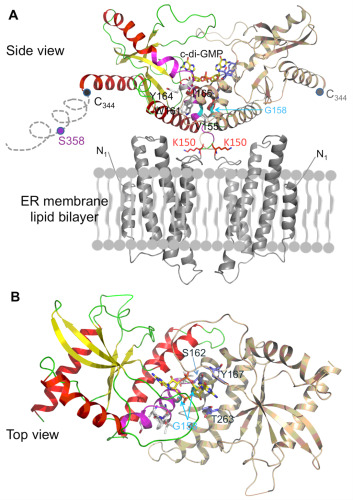
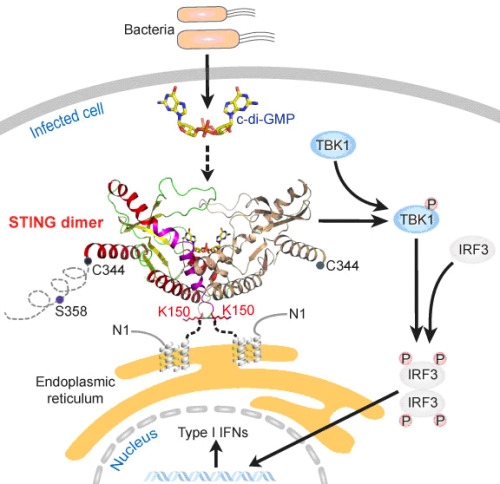
针对上述科学问题,本研究综合运用了X-射线晶体学,生物化学和细胞生物学技术。我们先后解析了STING CTD以及STING CTD与c-di-GMP二元复合物的晶体结构。发现STING CTD具有一种独特的构架(Unique architecture)(如图2所示),阐明了STING CTD形成功能性二聚体的分子机制,文献报道的最后一个跨膜区(153-173aa)其实并不是跨膜区而是STING CTD形成同源二聚体的疏水相互作用界面。STING CTD与c-di-GMP以一种全新的模式结合。据我们所知该结构是第一个发表的哺乳动物来源的蛋白质与c-di-GMP形成的复合物晶体结构。此外,我们还发现c-di-GMP能促进STING与TBK1结合,诱导I型干扰素的产生,从而激发机体抵抗病原体入侵的免疫反应。该研究工作的完成有助于深入了解STING在天然免疫信号通路中的作用,为揭示宿主细胞感知病原菌入侵的分子机制提供了直接的结构生物学证据,同时也为设计新的环鸟苷二磷酸类似物疫苗佐剂或免疫治疗药物奠定基础。
该项研究工作得到科技部、国家自然科学基金委和中国科学院的资助。国家大科学装置上海光源SSRF和美国劳伦斯伯克利国家实验室ALS提供了衍射数据收集的支持。
图2:STING同源二聚体功能模型。
A:STING与c-di-GMP复合物结构(侧面)模型。STING的N-端是预测的4次跨膜结构,C-端通过疏水性相互作用形成二聚体,c-di-GMP结合在STING二聚体相互作用界面上的沟槽中。粉红色区域为预测的最后一个跨膜区(153-173aa),实际上是STING二聚体形成的疏水性相互作用界面。 B: STING与c-di-GMP复合物结构(顶面)模型。
图3:病原菌引起的STING天然免疫信号通路激活示意图
(科技处报道)
(2012年5月11日)
(刘志杰课题组)
附件下载: