
美国科学院院刊发表生物物理所最新研究成果
发布时间:2011-12-09
2011年12月5日,Proceedings of the National Academy of Sciences (PNAS) 杂志在线发表了生物物理研究所许瑞明、龚为民、刘迎芳研究组以及遗传发育所鲍时来课题组合作的最新研究成果,该文章题为“Structural Insights into Protein Arginine Symmetric Dimethylation by PRMT5”。
组蛋白甲基化是表观遗传学的核心内容之一,主要包括赖氨酸和精氨酸的甲基化修饰。相对于赖氨酸的单甲基、双甲基和三甲基化修饰,精氨酸也存在单甲基及双甲基化修饰。精氨酸双甲基化修饰中,对称性及非对称性修饰有着不同的生物学意义及识别机制。如针对组蛋白H4R3位点的双甲基化修饰中,对称修饰抑制基因表达,非对称修饰则与基因激活密切相关。但关于这两类修饰的反应机理,特别是对称性与非对称性修饰酶催化机制的差别还知之甚少。这项工作解析了线虫精氨酸对称双甲基化酶PRMT5的晶体结构,根据已知的结构信息设计突变体实验,确定了PRMT5精氨酸甲基转移酶活性、特别是对称性双甲基化活性的关键残基,分析PRMT5作为对称性双甲基化酶与其他非对称性双甲基化酶的结构差别。这些对我们理解精氨酸双甲基化修饰的作用机理及调控细节具有重要意义。
该项研究工作得到科技部、国家自然科学基金委员会和中国科学院的资助。
(http://www.pnas.org/content/early/2011/12/02/1106946108.abstract)
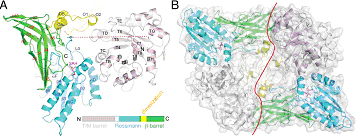
图解 线虫PRMT5晶体结构示意图,其活性单位为同源二聚体
(综合处报道)
(2011年12月9日)
(撰稿:许瑞明组 孙力涛)
附件下载: