
《PLoS Pathogens》发表生物物理所
2011年7月21日,著名杂志《PLoS Pathogens》发表了生物物理研究所饶子和院士研究组的李雪梅研究员与美国辛辛那提儿童病医院医学中心Xi Jiang教授研究组的共同研究成果,题为“Crystallography of a Lewis-Binding Norovirus, Elucidation of Strain-Specificity to the Polymorphic Human Histo-Blood Group Antigens”,阐述和探讨了诺罗病毒与Lewis型人类组织血型抗原受体(HBGAs)结合特异性的结构基础与分子机制。
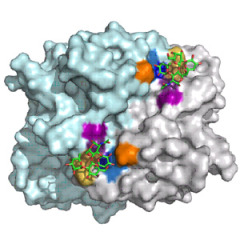
诺罗病毒(Norovirus)是引起人类传染性胃肠炎的主要非细菌性病原体。不同种株的诺罗病毒识别人体消化道粘膜上皮细胞表面的不同类型的组织-血型抗原,识别过程通过诺罗病毒衣壳蛋白的P结构域与HBGAs末端的寡糖残基结合来完成。VA207作为G-II基因群的病毒株,主要识别lewis型血糖抗原,这与目前已具有结构基础的VA387、诺瓦克病毒(Norwalk Virus)有着不同的结合模式。根据诺罗病毒VA207衣壳蛋白P结构域与Lewis四糖的复合物晶体结构研究发现,识别四糖的活性位点位于蛋白二聚体作用界面的口袋中,蛋白和四糖分子之间具有稳定而广泛的氢键网络体系,参与蛋白-寡糖相互作用的残基在诺罗病毒家族中具有较高的同源性,且作用模式属于典型的诺罗病毒G-II型基因族的作用模式。突变实验和蛋白-寡糖作用检测实验结果证实,参与该作用的氨基酸残基对于病毒与宿主的相互识别作用具有重要意义,对该残基的突变将导致与原来HBGAs寡糖分子结合能力的丧失并使其具有识别新的HBGAs寡糖分子的能力。通过对诺罗病毒衣壳蛋白与lewis寡糖复合物的结构和功能研究,有助于对诺罗病毒与HBGAs的识别作用和侵染宿主提供全面、合理的结构解释,同时为研发抗诺罗病毒药物提供重要的科学依据。
该研究课题得到了国家“863”计划、国家自然科学基金和重大疾病专项基金的资助。
 |
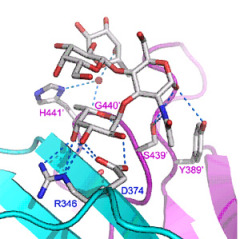 |
图示:诺罗病毒VA207衣壳蛋白P结构域与Lewis四糖复合物晶体结构,(左)Lewis四糖分子在衣壳蛋白表面的结合位点;(右)Lewis四糖与结合位点氨基酸残基的氢键网络体系。
(科技处报道)
(2011年9月5日)
附件下载: