基于深度学习的二维电镜图像细胞器互作统计分析方法-DeepContact
基于深度学习的二维电镜图像细胞器互作统计分析方法-DeepContact
2022年8月5日,中国科学院生物物理研究所徐涛课题组,胡俊杰课题组与计算技术研究所肖立团队在《Journal of Cell Biology》杂志上合作发表了题为“DeepContact: High throughput quantification of membrane contact site based on electron microscopy imaging”的文章,针对二维电镜数据开发了一种基于深度学习的细胞器互作高通量统计分析方法,DeepContact。
近十几年来,细胞器互作位点(membrane contact site, MCS)得到了生物医学领域的广泛关注。MCS是膜性细胞器之间形成的由蛋白复合体介导的动态物理相互作用,在信号转导,离子、脂类运输,细胞器形态重构等方面起到关键作用。遗传学、分子生物学等研究结果表明细胞器互作可能与多种生理、病理改变相关,如细胞分化,癌变,糖、脂类代谢以及多种神经退行性疾病的发生发展等。准确高效的MCSs定量分析方法将为细胞器互作与生物医学功能相关性的建立提供强有力工具。
很多研究尝试通过荧光显微成像进行MCSs的统计定量分析,但越来越多的实验结果表明过表达的荧光指示系统会让细胞器间产生人为拴系作用,导致细胞毒性,无法客观准确的指示细胞器互作的真实状态。电子显微镜可获取高分辨率细胞器全景图像,适于挖掘纳米尺度多种细胞器相互作用的定量信息。基于深度学习的高分辨三维体电镜数据细胞器互作分析方法已然建立起来,但此类前沿方法对设备,机时,算力要求高,而生物样本多具有高异质性,目前技术水平下三维体电镜难于满足统计相关性分析的样本量需求。基于手动分割的大样本量二维电镜数据分析可以得出生物学功能相关性结论,但方法在耗费巨大人力的同时无法排除人为主观判断的影响。
在DeepContact的设计过程中,研究人员借助语义分割算法预测二维电镜图片中的不规则ER网络的整体特征,运用实例分割算法预测形状规则细胞器形态特征,并引入最大似然和相似性对比方法降低假阳性。在识别和分割细胞器的基础上,提取细胞器边缘,进而量化特定细胞器间距上的MCS长度比率信息,实现无标记辅助的可视化和统计量化结果输出(图一)。相较于手动分割,DeepContact自动化分割在保证精准识别前提下,极大提高分割效率,同时排除了人为主观判断的影响。
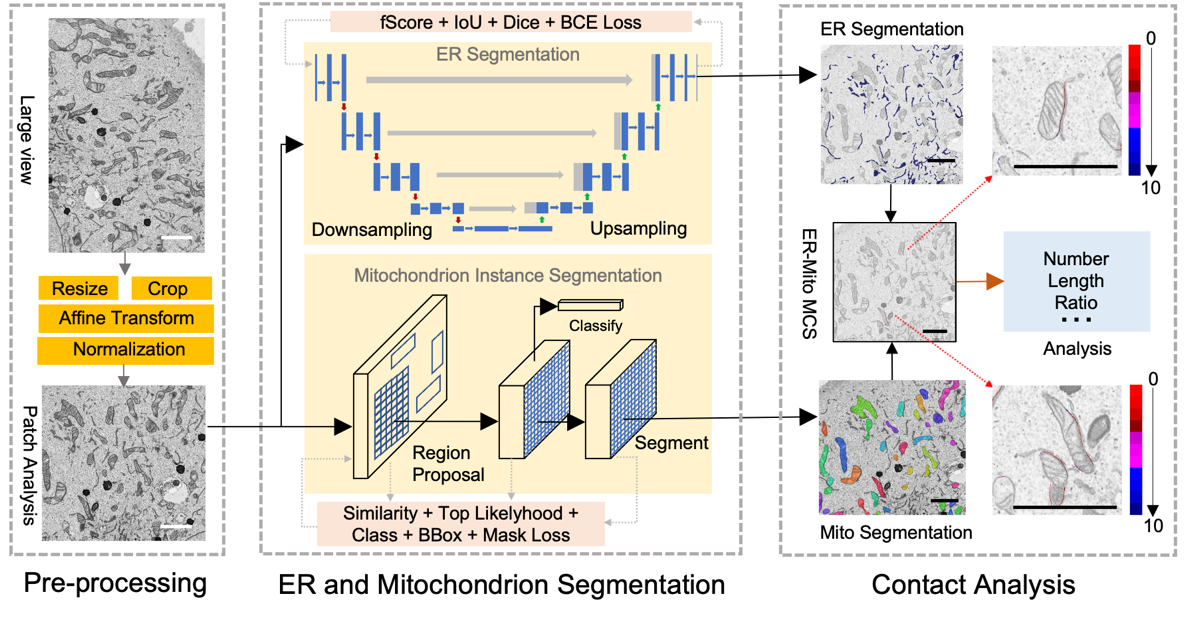
图一 DeepContact工作流程
研究人员还引入主动学习方法将新细胞器形态高效的扩展到DeepContact细胞器预测模型中,以便适应不同数据类型的分析需求。应用DeepContact,研究人员探查到了细胞器互作与基因功能相关性,并在多种饥饿和油酸处理组合的实验体系中揭示出内质网-线粒体和脂滴-线粒体两种细胞器相互作用在不同营养条件下的的协同变化特征(图二)。为适应机体组织样品中特异细胞类型中细胞器互作的分析需求,研究人员并进一步优化DeepContact分析流程,揭示了Sertoli细胞中内质网-线粒体互作随生精上皮周期进程发生周期性波形变化的特征 (图三)。
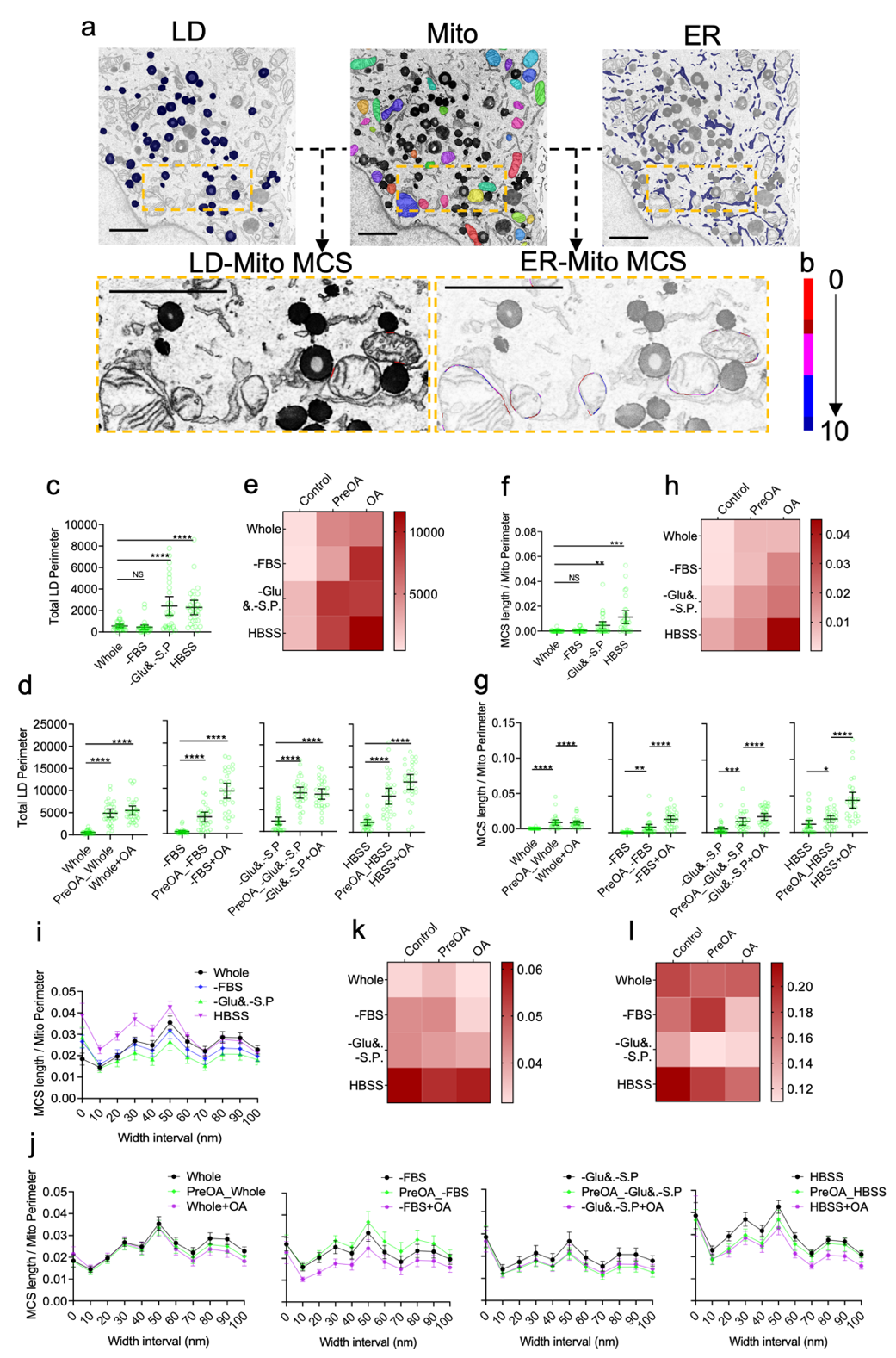
图二 不同营养条件下脂滴-线粒体和内质网-线粒体相互作用的协同变化。a, 脂滴(LD)-线粒体(Mito)以及ER-Mito互作的细胞二维电镜分割可视化。b, 表征细胞器互作位点宽度的比色尺,从蓝到红依次表征0-100nm。血清(-FBS)、葡萄糖结合丙酮酸钠(-Glu&-S.P)和HBSS饥饿处理,结合油酸前处理(PreOA)或者油酸同时处理(OA)营养状态下LD(c-e),LD-Mito互作(f-h),ER-Mito互作(i-l)变化。
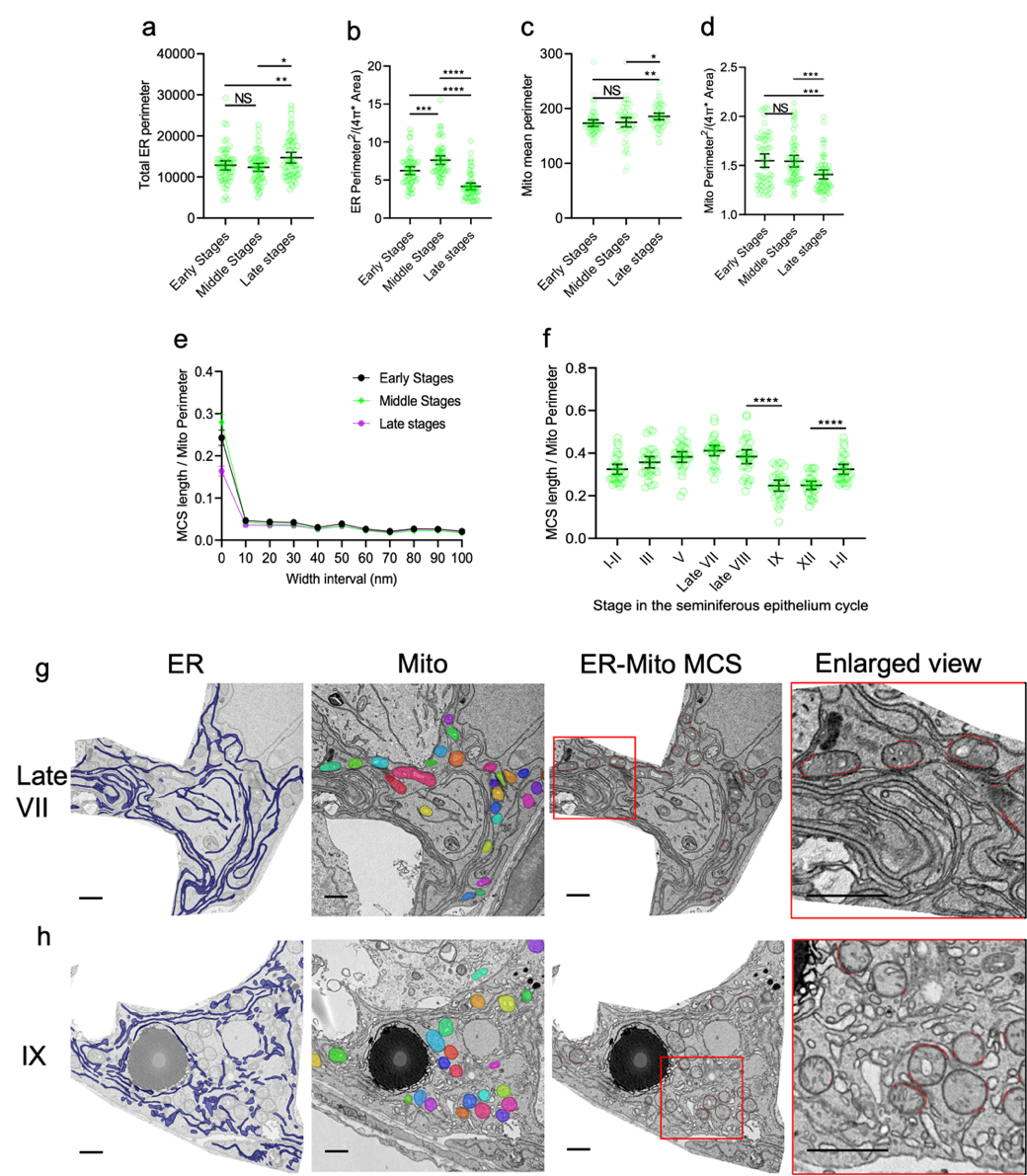
图三 生精上皮组织中Sertoli细胞的内质网-线粒体相互作用随生精上皮周期进程发生周期性波形以及细胞器、细胞器互作位点形态变化。e, 0-100nm间距ER-Mito 细胞器互作位点(MCS)在生精上皮周期前期,中期和后期的长度比率。f, 30nm间距ER-Mito MCS长度比率在生精上皮周期中的波形变化。生精上皮第VII期(g)和第IX期(h)ER、Mito和MSC的分割效果。
总之,应用DeepContact进行二维电镜数据进行分析,可容纳样本量大,支持细胞器互作网络的相关性研究;兼具组织电镜特异细胞类型分析能力,可扩展应用于超微医学病理学研究。DeepContact源代码、细胞器预测模型以及训练数据开源。细胞器预测分割模型可植入到图像分析软件Amira中,通过Amira图形界面进行调用(图四)。生物物理所生物成像中心可提供基于二维细胞电镜数据的细胞器互作相关分析服务。
目前已建立线粒体,ER和脂滴的DeepContact分割模型,这些模型主要针对ROTO方法制样的高衬度电镜数据类型,且所涵盖的细胞器类型,固定染色方案,组织、细胞类型,成像的电镜类型和图像分辨率都较为有限,需要应用过程中逐渐扩展以适应更广泛的科研需求。DeepContact边缘检测精度受到化学电镜染色,成像分辨率等影响,有待提高。研发人员会针对以上问题,主动增加训练数据类型,逐步升级DeepContact算法以提高细胞器边缘检测的精度,强化模型在不同成像条件下的域适应和泛化能力。连续超薄切片、FIB-SEM等体电镜成像,以及高分辨、大视野光电联合成像等是生物医学电镜的发展方向,有必要提升DeepContact基础算法,以适应未来更高通量的高分辨各向同性三维电镜统计分析需求。
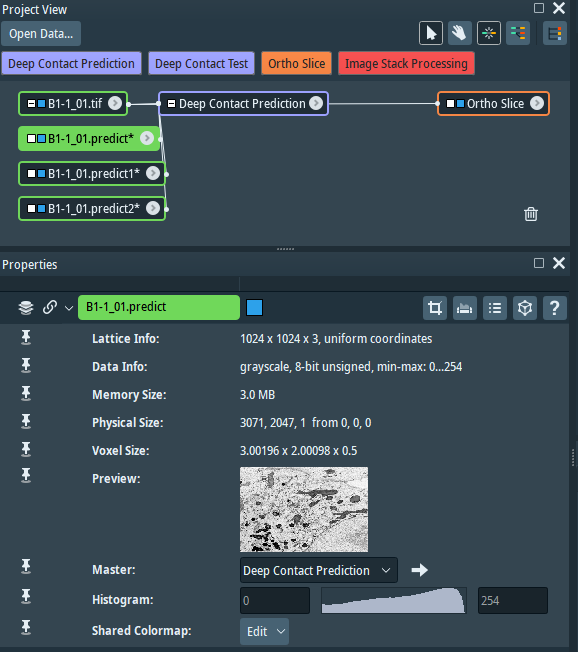
图四 使用Amira软件图形界面调用DeepContact模型进行细胞器互作分析。左图,DeepContact功能模块调用界面;右图,Amira中DeepContact模块参数设置界面。
中国科学院生物物理研究所徐涛院士、胡俊杰研究员,计算技术研究所肖立副研究员为本共同通讯作者。徐涛院士课题组博士后刘丽清,肖立团队硕士研究生杨树鑫为文共同第一作者。计算技术研究所硕士研究生刘阳和生物物理研究所生物成像中心李喜霞高级工程师参与了本项工作。电镜制样和数据收集工作得到了生物物理所生物成像中心相关工作人员的大力支持和帮助。本项目得到国家自然科学基金委员会项目,科技部重点研发计划和中国科学院战略重点研究计划支持。
文章链接: