前沿技术推介——徐涛院士课题组/徐平勇课题组合作发展了可实现超分辨光电关联成像的抗锇酸固定和树脂包埋的新型光转化荧光蛋白mEosEM
2019年10月14日,中国科学院生物物理研究所徐涛院士课题组与徐平勇课题组合作,在Nature Methods上发表了题为 “mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM”的研究论文。作者技术团队成员发展了第一个抗锇酸固定和环氧树脂包埋的荧光蛋白mEosEM,该蛋白在电镜制样后仍然能保持荧光亮度并具有光开关的活性。通过进一步优化超薄切片样品中单分子定位算法和成像方法,作者团队首次实现了环氧树脂后固定电镜样品的同层超分辨光镜-电镜关联成像。这种光电关联成像方法可以很好地保留线粒体等亚细胞超微结构,并具有单分子超分辨成像的定位精度,在大尺度样品的光电关联成像中极具应用潜力。
光电关联成像技术的核心难点在于同时获得高质量的电镜和光镜图片,以实现荧光显微镜高灵敏特异性定位与电镜高分辨率超微结构解析的优势整合。然而,受限于电镜成像的苛刻条件,尤其是常规电镜制样方法中,需要使用锇酸固定来保持细胞的超微结构和电镜衬度,以及环氧树脂包埋来保证样品的切片质量,但锇酸固定和环氧树脂包埋都极易造成荧光蛋白分子荧光信号的淬灭。故而,已有的光电关联成像方法中,往往需要以牺牲其中一种成像效果为代价去保全另一种成像效果。例如,前包埋光电关联成像技术流程中,为了尽可能保留荧光信号,需要先用光镜对整个细胞成像,然后再对细胞样品进行固定、包埋和切片以适用于电镜成像观察,而固定过程中样品会产生极大的形变,且整个细胞的光镜图像与超薄切片的电镜图像也难以匹配,从而导致电镜成像中不容易找到光镜图像中的同一细胞,即使找到也无法进行高精度的关联对准。又或者退而求其次,使用低浓度的锇酸或其他替代树脂,如GMA,LR white等,也可以提高荧光信号的保留效率,但与之对应的是电镜下超微结构的保持和图片衬度都要大打折扣。
也有研究人员尝试通过高压冷冻和冷冻替代的方法减少对荧光蛋白分子荧光信号的淬灭,实现了超分辨光电关联成像。但这种方法制备所得的样品在电镜成像时衬度往往较低。此外,受限于高压冷冻技术本身,这种制样方法也不适合大尺度的样品。
因此,发展抗锇酸固定和环氧树脂包埋的新型荧光蛋白分子,使得电镜超薄切片样品仍然能保有极好的荧光信号以获得高质量的荧光图像,同时也不影响高质量电镜数据的采集,并且可用于大尺度样品的体电子显微学分析,是当前光电关联成像的技术难点与主要攻关方向之一。
可以实现超分辨光电关联成像的光转化荧光蛋白mEosEM
绿色荧光蛋白(GFP)因能够提供活细胞和活体动物的靶向基因修饰标记而获得2008年诺贝尔化学奖,随后,在GFP基础上经由基因改造获得的光激活荧光蛋白(PAGFP)能够提供单分子特性,从而实现了超分辨显微成像(2014年诺贝尔化学奖)。在本文的作者团队中,徐平勇课题组的研究方向之一是发展新型荧光蛋白并使之应用于超高分辨显微成像研究。基于该技术团队前期研究工作,已经发表的新型荧光蛋白分子包括:光激活荧光蛋白mGeos(PNAS,2012),光转化荧光蛋白mEos3.1/mEos3.2(Nature Methods,2012),具有极高的光学稳定性的反复光激活绿色荧光蛋白Skylan-S(ACS Nano,2015),具有成熟快、发光早、光转化效率高等特点的光转化蛋白pcStar(Nano letters,2019)等,近年来被广泛应用于超分辨荧光成像和超分辨光电关联成像。随后,该技术团队以光转化蛋白mEos3.2为模板获得了具有更高亮度的突变体mEos3.2-M,并利用相同的突变手段对抗锇酸固定和GMA树脂包埋实验中筛选出的荧光亮度保持最好的荧光蛋白变种mEos4b进行突变,最终获得了第一个抗锇酸固定和环氧树脂包埋且具备较高亮度的荧光蛋白mEosEM,该蛋白在电镜制样后仍然能保持荧光亮度并具有光开关的活性,可以实现超分辨光电关联成像。
可以实现超分辨光电关联成像的光转化荧光蛋白mEosEM
绿色荧光蛋白(GFP)因能够提供活细胞和活体动物的靶向基因修饰标记而获得2008年诺贝尔化学奖,随后,在GFP基础上经由基因改造获得的光激活荧光蛋白(PAGFP)能够提供单分子特性,从而实现了超分辨显微成像(2014年诺贝尔化学奖)。在本文的作者团队中,徐平勇课题组的研究方向之一是发展新型荧光蛋白并使之应用于超高分辨显微成像研究。基于该技术团队前期研究工作,已经发表的新型荧光蛋白分子包括:光激活荧光蛋白mGeos(PNAS,2012),光转化荧光蛋白mEos3.1/mEos3.2(Nature Methods,2012),具有极高的光学稳定性的反复光激活绿色荧光蛋白Skylan-S(ACS Nano,2015),具有成熟快、发光早、光转化效率高等特点的光转化蛋白pcStar(Nano letters,2019)等,近年来被广泛应用于超分辨荧光成像和超分辨光电关联成像。随后,该技术团队以光转化蛋白mEos3.2为模板获得了具有更高亮度的突变体mEos3.2-M,并利用相同的突变手段对抗锇酸固定和GMA树脂包埋实验中筛选出的荧光亮度保持最好的荧光蛋白变种mEos4b进行突变,最终获得了第一个抗锇酸固定和环氧树脂包埋且具备较高亮度的荧光蛋白mEosEM,该蛋白在电镜制样后仍然能保持荧光亮度并具有光开关的活性,可以实现超分辨光电关联成像
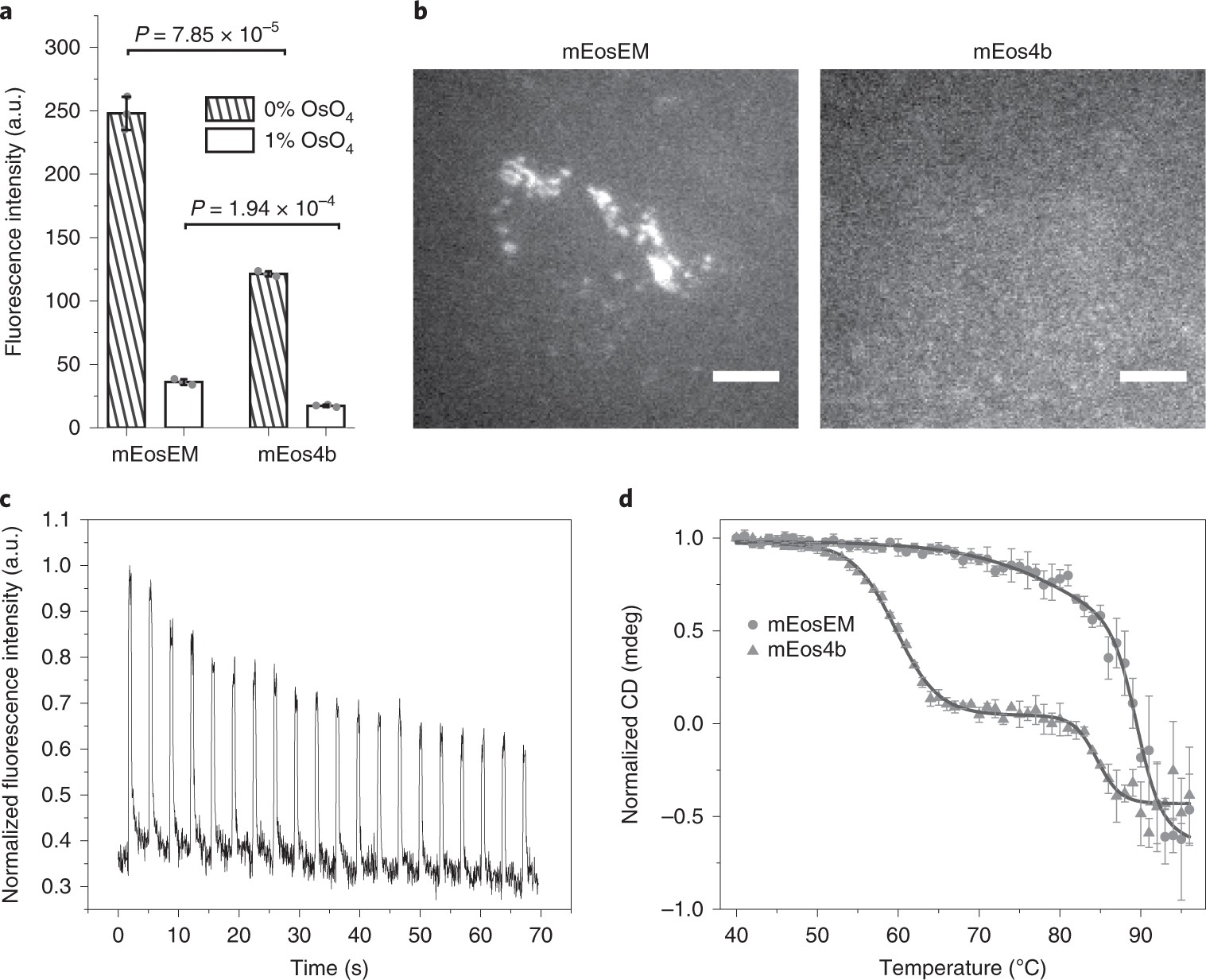
图1. mEosEM和mEos4b在锇酸固定和树脂包埋前后发光特性的变化对比。a图抗锇酸实验结果显示,锇酸固定前后,mEosEM相比于mEos4b都具有更高的荧光信号亮度;b图显示相比于mEos4b,mEosEM标记的线粒体在经过锇酸固定和树脂包埋后制备成100nm薄切片状态下,仍然可以保留极好的荧光信号;c图统计了约70s内,光开关蛋白mEosEM可被405nm/488nm反复开关循环的次数,以及信号强度随开关循环次数增加而逐渐衰减的情况;d图通圆二色光谱技术测定了mEosEM和mEos4b的热力学稳定性。
超分辨光电关联成像
在本文的研究中,技术团队成员使用mEosEM先后标记了中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)中的线粒体和核纤层蛋白(lamin A),通过锇酸固定与树脂包埋等电镜样品制备过程后,制备出了适用于超分辨光电关联成像的超薄切片样本,通过单分子定位超分辨成像显微镜(Photoactivated localization microscopy,PALM)获得了效果极佳的超分辨荧光图像以及光电关联成像结果。
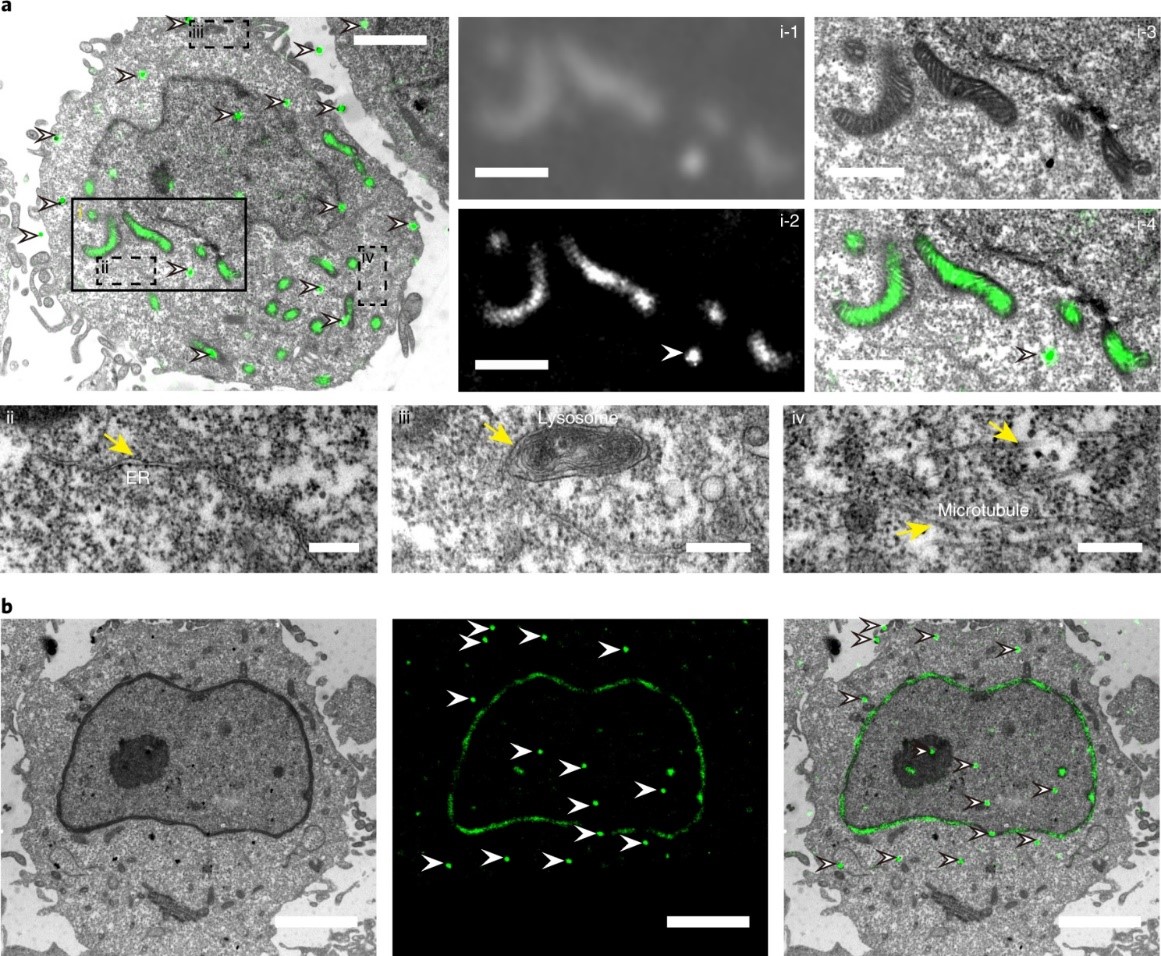
图2.基于新型光转化荧光蛋白mEosEM的超分辨光电关联成像。a, mEosEM标记CHO中的线粒体的超分辨光电关联成像结果;b,mEosEM标记CHO中的核纤层蛋白(lamin A)的超分辨光电关联成像结果。
文章讲述了一种基于新型抗锇酸固定和环氧树脂包埋的荧光蛋白mEosEM的超分辨光电关联成像技术,这种成像方法可以很好地保留线粒体等亚细胞超微结构,并具有单分子超分辨成像的定位精度。
此外,作者还发现,相比于乙二醇甲基丙烯酸脂法(GMA)包埋手段,在环氧树脂包埋条件下,用来恢复荧光蛋白分子的碱性缓冲液对电镜样品的结构影响明显小很多,因此更有利于提高光电关联成像中电镜图像的质量。而且,有报道称Durcupan(一种水溶性包埋剂)更适用于聚焦离子束减薄(FIB)样品制备技术,而实验证明mEosEM也同样耐受Durcupan包埋,因此也具备应用于FIB原位减薄样品以及后续的扫描电镜关联成像中可能,即,这种光电关联成像方法在大尺度厚样品的体电子学三维重构中极具应用潜力。
作者还发现,mEosEM在经历环氧树脂包埋后,不再具备绿光转红光的光转化特性,转而变为绿色单一通道的光开关效应,推测原因可能如下:
(1)环氧树脂的弱氧化性导致它容易成为电子接收体,阻断了红色荧光基团的激发途径;(2)树脂材料本身强大的交联特性和刚性结构,妨碍了红色荧光基团发光过程中所需的构象改变。
综上所述, mEosEM的发现为超分辨光电关联成像提供了更多新的可能,具有更高耐受性的高亮度荧光蛋白探针有助于实现仅使用少量拷贝的标记物就能对目标物进行高特异性标记并获得较好的成像信噪比的实验目的,而进一步研制mEosEM的多色突变体可以实现多色超分辨光电关联成像。
致谢:特别感谢中科院生物物理研究所徐平勇研究员、张名姝副研究员在本文撰写过程中给予的指导建议。
参考文献:
1. Zhifei Fu. et al. mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM. Nature Methods, 2019
2. Zhang M. et al. Fast Super-Resolution Imaging Technique and Immediate Early Nanostructure Capturing by a Photoconvertible Fluorescent Protein. Nano Lett. 2019
3. Xu F. et al. Live cell single molecule-guided Bayesian localization super resolution microscopy. Cell Res. 2017
4. Xi Zhang. et al. Development of a Reversibly Switchable Fluorescent Protein for Super-Resolution Optical Fluctuation Imaging (SOFI). ACS Nano, 2015