囊泡转运再循环过程中细胞膜重塑分子机理的新发现
2014年10月13日,最新一期的Developmental Cell上发表了中科院生物物理研究所孙飞研究组与合作研究单位关于囊泡转运再循环过程中ACAP1分子重塑细胞膜机理的最新研究成果,论文的标题为“A PH domain in ACAP1 possesses key features of the BAR domain in promoting membrane curvature”。
细胞膜的重塑(membrane remodeling)对于细胞器的生成、囊泡转运、细胞运动和胞质分裂等生理功能至关重要。含有BAR结构域的蛋白质家族被认为是重塑细胞膜的一类重要分子。已知BAR蛋白重塑细胞膜的分子机制有两类:一类是通过简单的脚手架(scaffolding)机制,即BAR结构域通过二聚化形成香蕉形结构,之后通过静电作用与细胞膜相互作用,以自身的曲率诱导膜变形;另一类叫做N-BAR,通过N端的疏水或两亲性螺旋结构插入细胞膜来产生不同的膜曲率诱导膜变形。然而,有很多蛋白,其BAR结构域需要相邻的PH结构域来共同诱导细胞膜变形,其中的分子机制尚不明晰。
孙飞研究组与哈佛医学院Victor Hsu研究组、香港城市大学范俊研究组合作,以ACAP1(ArfGAP with coiled coil, ANK repeat and PH)的BAR-PH结构单元为研究对象,通过冷冻电镜、X射线晶体学、分子动力学、生物化学和细胞生物学等多种技术手段,发现该结构单元在胞吞再循环过程中采用了不同于之前已知的两类细胞膜重塑机制,并对该机制的详细分子机理进行了解析。研究结果表明,在BAR-PH这样的结构单元中,PH结构域起到了关键作用,其通过识别磷酸化的磷脂酰肌醇来与细胞膜相互作用,并将一个两亲性loop结构插入细胞膜引起膜曲率并诱导膜变形,而BAR结构域仅仅起到一个支架作用,通过彼此相互作用在细胞膜上聚集,促进细胞膜的最终变形。在该项研究中,冷冻电镜三维重构数据提供了最直接的证据,而分子动力学模拟则进一步印证了冷冻电镜的观察结果和生化的数据。
事实上,除ACAP1外,还存在很多蛋白其含有BAR-PH结构单元,如ArfGAP家族和APPL蛋白等,此外还存在很多蛋白其含有PX-BAR结构单元,如sorting nexin家族,推测它们可能具有与ACAP1相似的膜结合和重塑功能。因此,该项研究所发现的细胞膜重塑分子机理可能广泛存在于囊泡转运分子过程中,为相关领域的研究提供了新的借鉴。
中科院生物物理研究所孙飞研究员与哈佛大学医学院Victor Hsu教授为该工作的共同通讯作者。论文第一作者孙飞组助理研究员庞效云是该工作的主要完成人。第二作者香港城市大学的范俊博士完成了分子动力学模拟的工作。第三作者孙飞组副研究员张艳博士完成了冷冻电镜图像数据的处理。本研究工作得到了科技部973计划,国家自然科学基金以及美国NIH的资助。
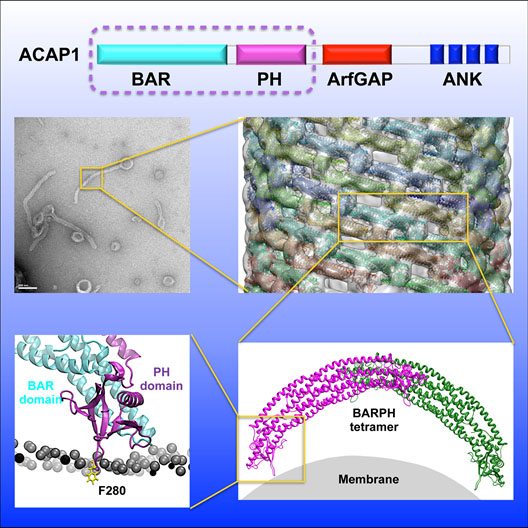
图示:ACAP1重塑细胞膜的分子机制。按照比例放大顺序:脂质体与BAR-PH孵育后的负染电镜图像;BAR-PH覆盖的管状结构的冷冻电镜密度图;BAR-PH螺旋结构在管状结构上的作用模型;分子动力学模拟PH结构域插入细胞膜的作用。
供稿:孙飞研究组
报道:科技处