
纳米酶打开催化治疗肿瘤之门
文 | 《中国科学报》记者 孟凌霄
当“纳米”遇上“酶”,一颗小小纳米酶诞生!而这或将成为解锁肿瘤治疗的“金钥匙”。
“纳米酶是一类新型催化剂,能够在生理或低温/高温条件下催化酶的底物,作为天然酶的替代品服务于人类健康。”中国科学院院士、中国科学院生物物理研究所研究员阎锡蕴说。
然而,在肿瘤微环境中,纳米酶治疗肿瘤效果依然有限。如何让纳米酶这把“金钥匙”达成更好的效果,是科学家们努力追寻的目标。
近日,中国科学院生物物理研究所研究员阎锡蕴、范克龙团队在《自然-通讯》发表最新研究成果,揭示了纳米酶模拟中性粒细胞多酶级联催化治疗肿瘤的新方法。
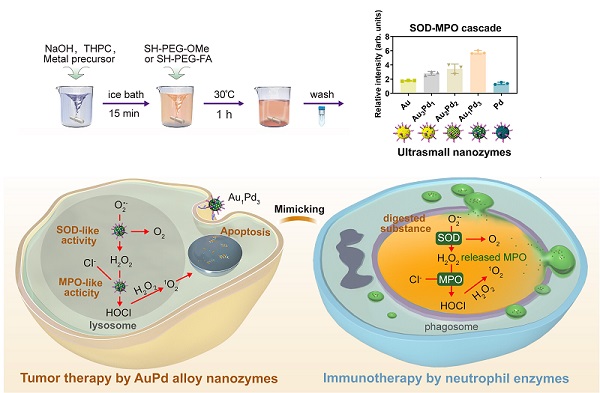
中性粒细胞酶促杀伤启发的纳米酶研发及其肿瘤催化治疗应用
免疫系统带来新灵感
经过多年发展,纳米酶的应用研究已经从体外诊断发展到体内催化治疗。
在肿瘤治疗方面,纳米酶能够催化过氧化氢产生活性氧自由基,有效杀伤肿瘤细胞。
然而,在肿瘤微环境中,过氧化氢的浓度往往低于0.1 mM,导致产生的活性氧自由基较少,大大限制了纳米酶治疗肿瘤的效果。
在人体对抗病原体感染的过程中,一种特殊的白细胞--中性粒细胞发挥着重要作用。它们会吞噬病原体形成吞噬体,通过氧化还原酶的多酶级联反应对病原体进行氧化“杀伤”,进而用多种水解酶将其“消化”。
在这一氧化杀伤机制中,超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)作为主要参与酶。受此启发,研究人员发现了纳米酶催化治疗肿瘤的新思路。
研究人员通过不断筛选并调整方案,开发出一系列同时具有类SOD和类MPO活性的超小金属纳米酶,并发现Au1Pd3合金纳米酶呈现出最高的级联活性。
“模仿”成功 效果提升
Au1Pd3合金纳米酶“学习模仿”中性粒细胞,发挥SOD-MPO“联合”杀伤作用,最终引起DNA损伤和细胞凋亡,达成持久的氧化杀伤效果。
研究人员在小鼠结肠癌CT26和乳腺癌4T1两种移植瘤模型上验证了Au1Pd3的治疗效果,同时为了增强Au1Pd3在小鼠体内的肿瘤靶向性,研究人员在Au1Pd3表面修饰了肿瘤靶向分子-叶酸(FA)。
在对照实验中,可以见到Au1Pd3和Au1Pd3-FA相比未治疗对照组可以显著抑制小鼠肿瘤的生长,而且Au1Pd3-FA由于具有对肿瘤的靶向性,治疗效果更好,甚至在CT26模型上有一只小鼠的肿瘤完全消失。
Au1Pd3和Au1Pd3-FA治疗均可以显著延长小鼠的生存期,在实验中,使用Au1Pd3和Au1Pd3-FA治疗的小鼠均全部存活,对照组的小鼠在20多天内全部死亡。
值得一提的是,这项研究中的新型纳米酶具有超小尺寸,直径只有3.5纳米。在小鼠实验中,研究人员能从尿液中发现完整的金属纳米酶颗粒,这意味着这类超小金属纳米酶具备肾清除功能,避免了纳米酶在体内的长期积累,保证了体内安全性。
此外,由于该纳米酶的催化底物在肿瘤细胞中的浓度高于正常细胞,使它在肿瘤细胞中能够产生更多的活性氧,具有肿瘤特异性杀伤。
为疾病治疗带来新希望
这项研究中模拟中性粒细胞多酶级联反应进行肿瘤治疗的仿生策略,未来将推动更多仿生治疗方法的开发,以用于抗菌、肿瘤或其他疾病的治疗。
而利用多酶活性纳米酶模拟含多种天然酶吞噬体的思路,也将促进纳米酶模拟细胞器(如溶酶体、过氧化物酶体等)方面的研究,未来有可能打造出纳米酶人造细胞器,乃至纳米酶人造细胞。
参考文献
https://www.nature.com/articles/s41467-024-45668-3
(来源:中科院之声)
(记者:孟凌霄)
附件下载: