
"后AlphaFold时代"的蛋白质折叠问题
如今,以AlphaFold为代表的使用深度学习人工智能(AI)的蛋白质结构预测方法,可以于几秒钟内完成在原子分辨率的蛋白质结构预测[1]。目前,几乎地球上所有已知的蛋白质结构都已被预测,生命科学的研究似乎已进入"后AlphaFold时代"。AlphaFold的发展给生命科学带来了新的可能,自然也带来了新的问题和挑战[2-3]。AI从已知蛋白质结构中提取样式,完全绕过了折叠过程,就好像通过快进到最后一幕而不看前两个小时来解读一部电影。正如Rose等[4]最近在《美国科学院院报》(PNAS)发表的评论中所说,"我们知道蛋白质折叠的结果,但不知道其中发生了什么"。值得注意的是,蛋白质折叠是在活细胞中进行的,但我们对细胞复杂环境内蛋白质折叠过程的理解还非常少。
关于蛋白质折叠最早的热力学研究可以追溯到1931年,中国科学家吴宪在《Chinese Journal of Physiology》上发表了世界上第一个蛋白质变性理论[5]。二十世纪六七十年代,诺贝尔奖得主Anfinsen提出了蛋白质折叠的热力学假说[6-7]。同一时期,邹承鲁领导的小组在牛胰岛素人工全合成工作中提出的"天然胰岛素的结构是所有AB异构物中最稳定的结构之一",也蕴含着蛋白质折叠的热力学问题[8]。此外,Anfinsen和邹承鲁在实验中都发现蛋白质折叠与环境因素有关,意味着其中还有动力学问题[6-8]。沿着热力学方向,Wolynes于1995年首次系统地阐述了能量景观模型[9] (图1)。如今,人们可以测定蛋白质折叠过程中多种热力学参数的变化[10]。在动力学研究方面,人们根据实验和计算机模拟研究提出了多种现象学模型以描述折叠过程中的结构变化[11]。
经典的蛋白质折叠问题,即多肽链如何折叠成具有三维结构的蛋白质分子,多是用体外实验进行研究的。然而,蛋白质折叠是在活细胞中进行的,细胞内的蛋白质折叠指新生肽链从核糖体上合成出来到最终成熟为有活性的功能蛋白质,还包括蛋白质的修饰、转运、跨膜、组装、分泌乃至降解等过程,其中蛋白质构象的动态变化也受到细胞内环境因素(如pH、离子、黏度、极性等)和其他生物大分子(如分子伴侣)的共同调节(图1)。邹承鲁曾多次提出要考虑细胞内的蛋白质折叠问题[12-13]。由于细胞环境的多样性和复杂性,研究细胞内的蛋白质折叠问题更加具有挑战性。目前,很多实验证据表明细胞内蛋白质存在共翻译折叠现象,其受到蛋白质自身特性及其他因素的调控[14-15]。
进入"后AlphaFold"时代,科学家们更需要通过跨领域的深度交叉融合来解析蛋白质折叠问题。AI辅助的结构解析能给细胞内蛋白质全景图的绘制提供强大助力,而深入揭示细胞内影响蛋白质折叠和功能的各种调节因素又会给AI的训练提升提供更多的反馈信息,有助于全方位描绘细胞内蛋白质动态图景。随之而来的将会是对蛋白质折叠背后的物理化学原理更深入的理解,这对于准确预测蛋白质结构,理性设计乃至生产有特定功能的新型蛋白质,有效治疗蛋白质折叠异常相关疾病等具有重要意义(图2)。
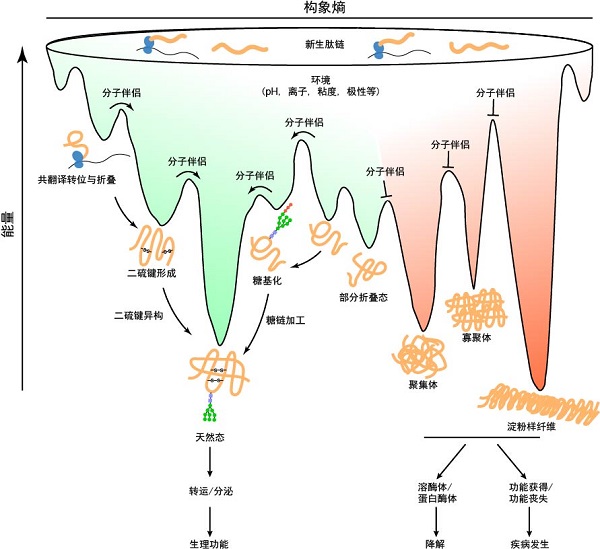
图1 蛋白质折叠的能量景观模型
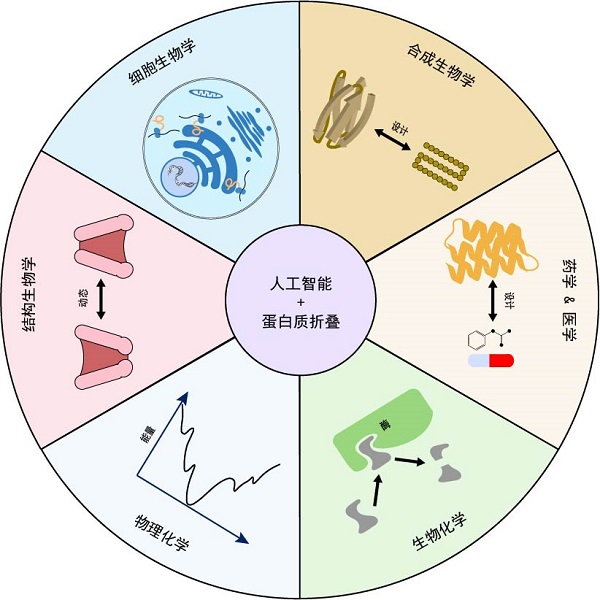
图2 "后AlphaFold时代"对蛋白质折叠问题的深入理解有望给生命科学各领域带来新的突破
后记:今年恰逢我国著名生物化学家邹承鲁先生百年诞辰。近日,中国科学院生物物理研究所王磊/王志珍团队在《科学通报》发表了题为《"后AlphaFold时代"的蛋白质折叠问题"》的观点文章,回顾了蛋白质折叠早期的研究历史,特别是中国科学家的贡献。文章总结了在体外和体内对蛋白质折叠问题的研究成果,并展望了在"后AlphaFold时代"对蛋白质折叠问题的跨领域研究可能给生命科学带来的突破。
参考文献
[1] Jumper J, Evans R, Pritzel A, et al. Highly accurate protein structure prediction with AlphaFold. Nature, 2021, 596: 583-589
[2] Callaway E. What's next for AlphaFold and the AI protein-folding revolution. Nature, 2022, 604: 234-238
[3] Moore P B, Hendrickson W A, Henderson R, et al. The protein-folding problem: not yet solved. Science, 2022, 375: 507
[4] Chen S J, Hassan M, Jernigan R L, et al. Opinion: protein folds vs. protein folding: differing questions, different challenges. Proc Natl Acad Sci U S A, 2023, 120: e2214423119
[5] Wu H. Studies on denaturation of proteins. XIII. A theory of denaturation. Chin J Physiol, 1931, 5: 321-344
[6] Anfinsen C B, Haber E, Sela M, et al. The kinetics of formation of native ribonuclease during oxidation of the reduced polypeptide chain. Proc Natl Acad Sci U S A, 1961, 47: 1309-1314
[7] Anfinsen C B. Principles that govern the folding of protein chains. Science, 1973, 181: 223-230
[8] Du Y C, Chang Y S, Lu Z X, et al. Resynthesis of insulin from pure A and B chains. Acta Biochimica et Biophysica Sinica, 1961, 01: 13-25
[9] Bryngelson J D, Onuchic J N, Socci N D, et al. Funnels, pathways, and the energy landscape of protein folding: a synthesis. Proteins, 1995, 21: 167-195
[10] Rico-Pasto M, Zaltron A, Davis S J, et al. Molten globule-like transition state of protein barnase measured with calorimetric force spectroscopy. Proc Natl Acad Sci U S A, 2022, 119: e2112382119
[11] Bhatia S, Udgaonkar J B. Heterogeneity in protein folding and unfolding reactions. Chem Rev, 2022, 122: 8911-8935
[12] Tsou C L. Folding of the nascent peptide chain into a biologically active protein. Biochemistry, 1988, 27: 1809-1812
[13] Tsou C L. The second genetic code. Chin Sci Bull, 2000, 45: 1681-1687
[14] Waudby C A, Dobson C M, Christodoulou J. Nature and regulation of protein folding on the ribosome. Trends Biochem Sci, 2019, 44: 914-926
[15] Chan S H S, W?odarski T, Streit J O, et al. The ribosome stabilizes partially folded intermediates of a nascent multi-domain protein. Nat Chem, 2022, 14: 1165-1173
作者简介

胡昕炜:中国科学院生物物理研究所在读博士研究生, 目前从事内质网稳态与应激方向的研究。

王磊:中国科学院生物物理研究所研究员, 博士生导师, 中国科学院大学岗位教授。主要从事内质网蛋白质氧化折叠、内质网稳态与人类健康等方面的研究。
附件下载: