
驱动蛋白--细胞里穿行的纳米"火车"
你听说过驱动蛋白吗?
这是一类体积微小,但是功能强大的ATP酶。
说它体积微小,是因为典型的驱动蛋白只有几十纳米,相当于头发丝直径的千分之一。
而说它功能强大,是因为在我们的身体里有上亿个这样的蛋白质,它们通过水解ATP产生动力,穿行在细胞里的微管轨道上,把各种营养、补给输送到细胞的每个角落,就像一列列忙碌的"火车"。
细胞内负责运输 "货物"的驱动蛋白
博士生一个意外的发现
人们能发现驱动蛋白,多亏了显微成像技术的发展。
1981年,科学家把一台当时非常先进的显微镜对准了乌贼的巨大神经元。在神经元的轴突中观察到了一些大小为30~50 nm的小囊泡,正在以5 μm/s的速度沿着一种线性物质运动,移动方向还有正有反。
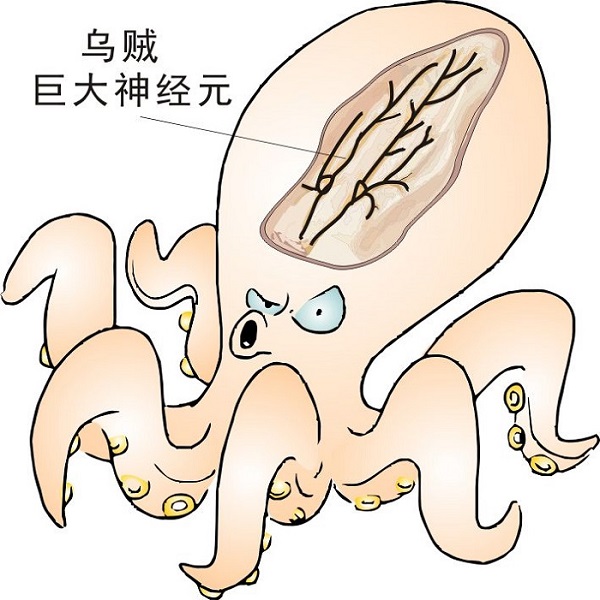
巨型乌贼(Architeuthis)与驱动蛋白的发现
这是之前从未观测到的现象!科学家们的兴趣来了:它们是怎么动起来的?
那个时候,另一种运动蛋白--肌球蛋白已经被发现。科学家们在肌球蛋白上连上塑料小球,这些小球就能在微丝上运动起来。
受到启发,当时还在读博士的Ronald Vale思索着:乌贼轴突里让这些小囊泡动起来的,会不会也是肌球蛋白呢?为了验证这个猜测,他把连有肌球蛋白的塑料小球注射到乌贼轴突中,观察这些小球是否能沿着轴突运动。然而预期的情况没有发生,倒是作为空白对照组的塑料小球动了起来。
这让他很费解,于是进一步把乌贼轴突的外膜去掉,只留下轴浆重复之前的实验。结果和上次一模一样。
好在Ronald Vale这次改进了实验方案,能够更加清楚地看到小球运动所依赖的轨道:是微管而不是微丝。
"所以,一定还有别的马达蛋白在负责乌贼轴突内的物质运输!"Ronald Vale想。这次他设计了一个非常精巧的实验:把体外纯化的微管聚合起来,铺成轨道;把从乌贼轴突里纯化的细胞器加进来,作为货物;然后又加入必需的能量:ATP。然而让他失望的是,这些货物一动不动。
"一定是缺少某些关键组分",Ronald Vale心想。于是,他在上述实验的基础上又添加了一些轴突提取物的可溶成分(含有成百上千种蛋白质的混合物),终于又观察到了货物的运动。
现在有两种可能性:一、在新添加的轴突提取物中包含能让货物动起来的未知物质;二、在新添加的轴突提取物中有其他能动的货物。
于是他增加了一个对照实验:把微管、ATP、轴突提取物的可溶成分混合在一起,然后滴在玻片上放到显微镜下观察。原本他期待看不到任何现象,然而奇怪的事情又发生了,这一次微管竟然象虫子一样动了起来(后来这个实验被命名为驱动蛋白运动实验,直到30多年后的现在,还被用来检测分子马达的运动行为)。
一番思索后,Ronald Vale认为,混合物中应该有某种马达蛋白,一端附着在了玻片上,另一端则黏附着微管,从而引起了微管的运动。他推测,这些马达蛋白应该就藏在轴突提取物的可溶成分内。
所以接下来要做的,就是从含有成百上千种蛋白质的混合物中找到它。Ronald Vale花了半年的时间,不断地从乌贼轴突可溶成分里纯化蛋白质,然后用驱动蛋白运动实验进行筛选。
功夫不负有心人,1985年伊始,Ronald Vale终于提取到了一种全新的、负责轴突内货物运输的分子马达,他把这个蛋白质命名为Kinesin。按照Ronald Vale的说法,这个名字来源与他与母亲的一通电话,电话那头的母亲突然想到了一个希腊词汇Kinein(意思为"运动"),能够恰当地描述这个分子马达,因此命名为Kinesin(中文名为"驱动蛋白")[1]。
后来的研究发现,驱动蛋白存在于所有真核生物体内,从单细胞的酵母到多细胞的真菌,再到高等植物以及哺乳动物细胞内都能发现它们忙碌的身影。
驱动蛋白有着庞大的家族,在人体内有14类共45种驱动蛋白。不仅如此,驱动蛋白还有远房亲戚--肌球蛋白和G蛋白,不过这件事着实让科学家们感到讶异。起初,科学家们并不认为它们之间会有什么联系,因为三者在个头、序列方面差异都太大了。然而在对三者的马达结构域进行了仔细分析后发现,它们马达结构域的核心部件惊人相似,动力产生的方式几乎是一样的,这才把他们归为了一族[2]。
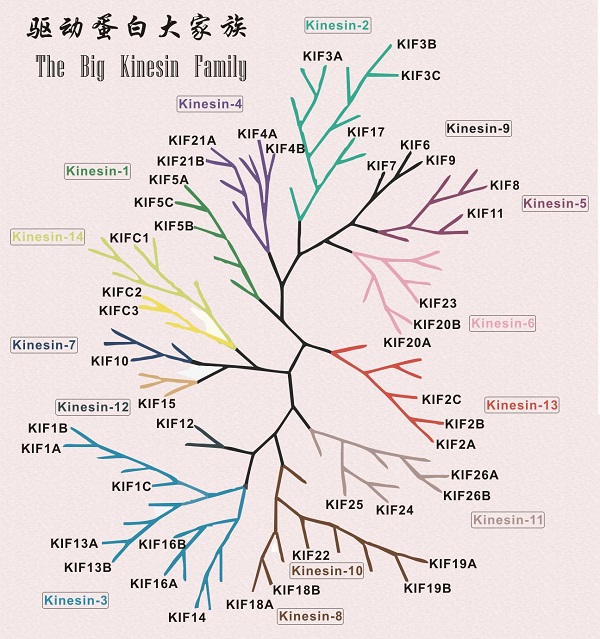
驱动蛋白庞大的家族
(在该驱动蛋白的系统发生树中仅显示了人体内存在的驱动蛋白)
像人一样"行走"
驱动蛋白是怎么运动的呢?
虽然被比作纳米"火车",但驱动蛋白的运动方式反倒跟人走路很接近。
人走路需要两条腿,驱动蛋白也需要两条"腿",大多数情况下是两条一模一样的"腿",有时候也可以是两条不一样的"腿"。每条"腿"上最核心的部件就是马达结构域,大约由350个氨基酸组成,可以结合微管和ATP。这个马达结构域就好比人的"脚",可以为驱动蛋白提供动力。马达结构域后面是动力传递装置,顾名思义负责传输动力;紧接着是铰链区,负责将驱动蛋白的两条"腿"固定到一起;在铰链区后面则是一个用来承接货物的接口。
在"行走"的时候,驱动蛋白的两条腿一前一后,前"脚"踩在微管轨道上,微管轨道的结合帮助前"脚"排除废弃物ADP,以便于空出位置结合ATP。ATP的水解触发前"脚"发力做功。前"脚"一发力把动力传递装置来了个大翻转,这一翻转就把后"腿"甩到了前面,于是后"腿"变成了前"腿",开始走下一步[3]。
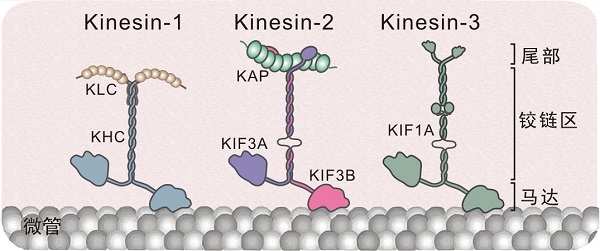
驱动蛋白的结构
图中展示了三种有代表性的驱动蛋白:kinesin-1(由重链(KHC)和轻链(KLC)组成)、kinesin-2(由KIF3A、KIF3B和KAP组成)、kinesin-3(KIF1A)。
有的驱动蛋白天生好脚力,一口气能走上百歩;也有的驱动蛋白脚力差,走几歩就得停下来喘口气;甚至有些驱动蛋白,天生不爱运动。从具体数值上看,驱动蛋白的运动速度在0.02~2 μm/s之间,而行程(从开始行走到从微管上掉下来的走的距离)在几个到十几微米不等。
作为细胞里的小"火车",驱动蛋白可谓非常高效节能,每消耗1个ATP分子,就会向前迈出8 nm,并可以承受约6 pN的拉力。根据这些数据,大致可以计算得到驱动蛋白马达的能量转换效率约50%,这样的效率使得人类发明的发动机在它面前都逊色不少[4]。如果把驱动蛋白放大到人的尺度,相当于一个人每秒移动600 m,也就是 2000 km/h。
为什么驱动蛋白会有这么高的效率呢?这是因为驱动蛋白能直接将化学能转化成机械能,而不像汽油发动机一样,需要先将化学能转化为热能,再把热能转化为机械能。没有了"中间商",效率当然就上去了。
除了能耗低外,驱动蛋白还是节能小标兵。在不运输货物时,驱动蛋白会脱离微管轨道并进入"休眠"模式,这样做可以有效防止能源浪费,同时也避免了微管轨道的交通堵塞。
更有意思的是,驱动蛋白在休眠时会折叠成"自抑制"状态。不同的驱动蛋白还会采用不同的"自抑制"折叠模式:比如驱动蛋白3家族在"休眠"时,会将原本的两条"腿"拆开,这还没完,拆下来的"腿"还会继续弯折将消耗ATP的马达结构域包围起来[5];而驱动蛋白1"休眠"时,不会将两条"腿"拆开,但是尾部的一个结构会插入到两个马达结构域之间,把两个马达结构域锁定到一起[6]。
那么驱动蛋白是如何识别"货物"的呢?
前面提到驱动蛋白有一个承接货物的接口,不同的驱动蛋白有不同的接口,从而决定了它运输货物的种类。而细胞内的这些货物常常会结合多种货物接口,这样就造成了不同驱动蛋白工作的交叉重叠。比如,至少有6种驱动蛋白与皮肤黑色素细胞中的黑色素小体转运有关。虽然工作有分工,但也少不了协作。货物很重时,多个驱动蛋白就会组成一个团队,就像旧时的纤夫一样,喊着号子、步调一致地往前走。有时候,它们还会像接力赛跑的运动员那样,将货物进行"交接",一个驱动蛋白运行了一段距离,把货物交给另一位"等待者",由后者继续传送。
不同的驱动蛋白会被细胞指派到不同地点去分管不同工作。每个驱动蛋白都可以多次执行任务。当把货物运送抵达目的地后,它们或者懒洋洋的随着细胞内的"洋流"到处飘荡,或者通过大型运输器械分组运送回细胞中心;或者被拆缷后将部件回收[7]。曾有人对不同组织细胞内的驱动蛋白的寿命做了一次普查。结果发现,驱动蛋白中存在寿命长达十几天的长寿家族,也有只能存活3天的家族,而平均寿命在6天左右[8]。此外,除了家族遗传外,工作环境和不同任务对其寿命也有一定的影响[8]。
驱动蛋白的团队协作
不只是"搬,搬,搬"
在很多人的印象里,驱动蛋白每天的事情就是"搬,搬,搬",实际上驱动蛋白所做的远远不只是运送货物。
有些驱动蛋白会一边走一边拆除微管轨道,以此来控制微管轨道的动力学性质;有些驱动蛋白通过参与染色体分离、纺锤体形成而调节细胞有丝分裂和减数分裂;还有些驱动蛋白能够参与纤毛的功能。
这些基础功能对许多生理过程都至关重要,例如胚胎发育、神经元生长、纤毛形成和功能维持等。
在过去几年里,越来越多研究表明驱动蛋白功能障碍与人类疾病密切相关[10]。驱动蛋白基因的变异会导致先天性疾病,同一基因的不同突变有时候会导致非常大的表型差异。KIF1A上的多处突变会造成一种好发于儿童或青春期的疾病--遗传性痉挛性截瘫(HSP),临床表现为缓慢进展的双下肢痉挛性肌无力[11];KIF3A的遗传变异与湿疹、哮喘、食物过敏等疾病相关;KIF5A基因突变能够扰乱关键蛋白质在连接脑和脊髓神经元轴突内的上下运输,最终导致"渐冻症"的发生[12];KIF21A的突变引发先天性眼外肌纤维化综合征(CFEOM),影响患儿的容貌、智力,目前产前诊断常用的超声等影像学手段不能够有效地发现该类胎儿,只有通过基因组测序才能诊断这些疾病[10-12]。
此外,驱动蛋白的抑制剂成了已经成为了潜在的抗癌药物。在有丝分裂过程中,驱动蛋白11家族成员Eg5定位于纺锤体微管,参与中心体的分离和纺锤体的形成。Eg5在多种肿瘤细胞高表达,是癌症化疗法中的一个药物靶点。针对Eg5设计的化合物已经进入了临床研究,但大部分化合物对于抑制肿瘤效果不佳。此外,目前还有一款名为ARRY-520的化合物在治疗多发性骨髓瘤方面显示出良好的效果并已经进入临床三期。然而近期研究显示,ARRY-520在Eg5上的结合位点与之前失败的药物一样,由此推测随着肿瘤细胞不断变异带来的抗药性可能使得ARRY-520也渐渐失效,这些都给尚未揭盲的临床研究笼罩了一层阴霾[13]。
科学家研究驱动蛋白,是为了什么?
20世纪80年代中期,驱动蛋白的发现是细胞生物学研究历史上的一个标志性事件。近40年的时间里,驱动蛋白相关研究走过了起步、形成、繁荣阶段,目前处于一个稳定期,相关的研究结果还在不断地涌现。
目前的研究有几个关注点:一是针对于驱动蛋白自身的研究:例如,驱动蛋白在"行走"时两条腿如何进行"协调";如何维持"休眠"模式,怎么从休眠模式切换到工作模式等。
第二是驱动蛋白在细胞中发挥功能的研究:由于驱动蛋白家族庞大、数目众多,对于每个驱动蛋白家族成员来讲,其识别的"货物"、如何识别"货物"以及发挥功能的具体机制还有待探究。这些机制的研究,有助于解释驱动蛋白异常导致的疾病发病机理并有助于疾病的治疗。
第三则是关于驱动蛋白改造方面的研究:驱动蛋白作为天然的纳米马达,尺寸小、效率高[14]。
如果能借助基因工程手段,把驱动蛋白改造成一个纳米机器人完成指定的任务,必将有助于生物研究、生物工程以及医学等科学领域。
参考文献
1. Ron vale, Discovering Kinesin. http://www.ibiology.org/cell-biology/kinesin/
2. Rayment I. Kinesin and myosin: molecular motors with similar engines. Structure, 1996, 4(5):501-504
3. Yildiz A, Tomishige M, Vale R D, et al. Kinesin walks hand-over-hand. Science, 2004, 303(5658):676-678
4. Calvin Smith, Incredible Kinesin! Biological 'robots' will blow your mind! https://creation.com/incredible-kinesin
5. Wang W, Ren J, Song W, et al. The architecture of kinesin-3 KLP-6 reveals a multilevel-lockdown mechanism for autoinhibition. Nat Commun, 2022, 13(1):4281
6. Kaan H Y K, Hackney D D, Kozielski F. The structure of the Kinesin-1 motor-tail complex reveals the mechanism of autoinhibition. Science, 2011, 333(6044): 883-885
7. Blasius T L, Reed N Slepchenko B M, et al. Recycling of Kinesin-1 Motors by Diffusion after Transport. PLoS One, 8(9):e76081
8. Fornasiero E F, Mandad S, Wildhagen H, et al. Precisely measured protein lifetime in the mouse brain reveal differences across tissues and subcellular fractions. Nat Commun, 2018, 9(1):4230
9. Konjikusic M J, Gray R S, Wallingford J B. The developmental biology of kinesins. Dev Biol, 2021, 469:26-36
10. Kalantari S, Filges I. 'Kinesinopathies': emerging role of the kinesin family member genes in birth defects. J Med Genet, 2020, 57(12):797-807
11. KIF1A.ORG featured in ken burns documentary: the gene. https://www.kif1a.org/
12. Nicolas A, Kenna K P, Renton A E, et al. Genome-wide Analyses Identify KIF5A as a Novel ALS Gene. Neuron, 2018, 97(6):1268-1283.e6
13. Indorato R L, Talapatra S K, Lin F, et al. Is the fate of clinical candidate arry-520 already sealed? Predicting resistance in Eg5-inhibitor complexes. Mol Cancer Ther, 2019, 18(12):2394-2406
14. Khataee H and Khataee A. Application of molecular motors in intelligent nanosystems. Digest Journal of Nanomaterials and Biostrctures, 2009, 4(4):613-621
作者简介:
任锦启

中国科学院生物物理研究所冯巍组副研究员。研究方向为驱动蛋白介导的细胞内物质转运。
科学寄语
多探索,多发现!
宋维叶

中国科学院生物物理所冯巍组博士研究生,研究方向为驱动蛋白不同成员的自抑制分子机制。
科学寄语
路漫漫其修远兮,吾将上下而求索。
附件下载: