
肠道类器官:揭开肠道健康的"神秘面纱"
肠道作为人体消化系统的重要组成部分,承担着食物消化、营养物质吸收和代谢的重要任务。而且,肠道不仅是人体的消化器官,也是人体重要的免疫器官。当肠道受损时,会引发多种肠道疾病,包括炎症性肠病、乳糜泻、结直肠癌等。
常见肠道疾病
谈及人体健康的奥秘,肠道疾病无疑是一个不可忽视的影响因素。肠道的健康直接关系到我们整体的健康状态,一旦肠道健康受损,不仅会导致营养吸收不良等问题,还会引发一系列肠道疾病。然而,随着现代生活节奏的加快和饮食习惯的改变,肠道疾病的发病率逐年攀升,成为影响人们生活质量的重要因素之一。根据国家癌症中心2024年3月发表于《中华肿瘤杂志》的《2022年中国恶性肿瘤流行情况分析》中数据表明,2022年我国结直肠癌新发病例数位于恶性肿瘤第二位[1]。以下为常见的肠道疾病:
肠应激综合征:慢性肠道疾病,主要影响下消化系统,即大肠。
炎症性肠病:慢性炎症性肠道疾病,主要分为克罗恩病和溃疡性结肠炎。
结肠直肠癌:消化道中常见的恶性肿瘤,三大消化道癌症之一。
乳糖不耐症:由于缺乏能够分解乳糖的酶,导致肠道无法吸收乳糖。
乳糜泻:慢性小肠疾病,麸质引发免疫系统紊乱导致小肠绒毛受损。
囊性纤维化:遗传性外分泌腺疾病,易引起新生儿胎粪性肠梗阻等。
阑尾炎:最常见的急腹症疾病,由阑尾感染引起炎症和剧烈疼痛。
传统体外肠道模型的缺陷
传统的体外肠道模型主要分为三类:动物模型、二维肠道细胞或永生化细胞系。由于模型自身的缺陷,导致肠道的体外研究以及肠道疾病的机制探究无法进一步深入。虽然动物模型广泛应用于临床试验,但是与人体肠道生理特征的差异,导致其无法完全反映人体肠道疾病的复杂原因。同时,也受制于相关实验动物管理条例,由动物实验所产生的伦理及动物福利问题也不容忽视[2]。而二维细胞模型由于缺乏细胞-细胞和细胞-微环境之间的作用,无法有效模拟天然肠道的生理特征,极大地限制了其在疾病模型构建领域的应用。肠道类器官的出现和发展克服了传统二维细胞和动物模型的诸多限制,助力肠道病理学发展。
肠道类器官
肠道类器官是由来自肠道的隐窝或单个干细胞在体外培养体系中形成的三维组织类似物,具有自我更新和分化能力。2009年,Hans Clevers团队成功地将富含Lgr5+的小肠干细胞通过体外培养形成了具有隐窝-绒毛状上皮区域的三维细胞团,产生了首个肠道类器官[3]。由此开启了类器官构建的新纪元,也促使新型体外肠道模型研究进入了快速发展的新阶段。此后,人源小肠、结肠和肠癌等类器官相继问世。
肠道类器官的构建
在体外将离体的肠道干细胞或隐窝培养成肠道类器官,其关键之处在于如何还原肠道干细胞增殖、分化和迁移所需的微环境。在天然肠道中,肠道干细胞的生态位是由一群不同的肠道细胞所组成的复杂结构,主要包括潘氏细胞、肠间质细胞、成纤维细胞、淋巴细胞、神经细胞等[4]。这些细胞通过分泌细胞因子,调节肠道上皮稳态,维持肠道干细胞的适宜生存环境。例如,间隔分布在肠道干细胞中的潘式细胞可以合成并分泌Wnt3、EGF等生长因子,还可以产生溶菌酶防止有害菌的侵入[5]。此外,细胞外基质为肠道上皮细胞提供了结构支撑,这种物理性生态位是由基底膜和固有层组成的。同时,细胞外基质还承担着传递生物化学信号的责任。多种信号通路沿隐窝-绒毛轴呈梯度排列,其中的关键信号通路包括Wnt、Notch、EGF和BMP信号通路。不同信号通路在隐窝-绒毛轴不同区域的浓度差异决定了各肠道上皮细胞的位置分布[6-10]。
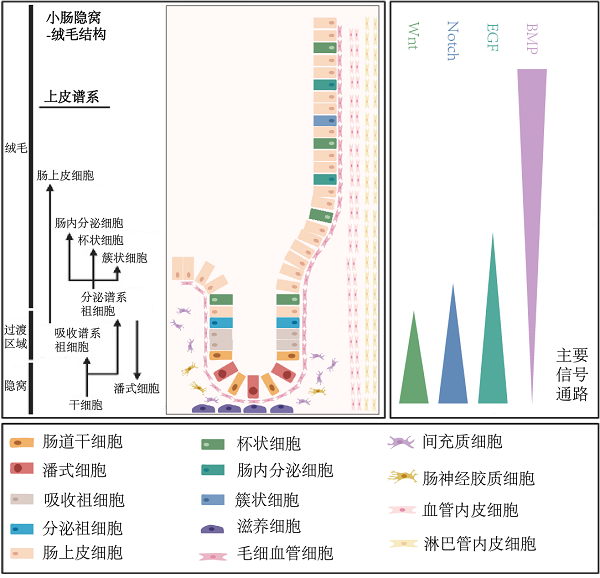
图1. 肠道干细胞生态位及其分化命运(改编自[11])
肠道类器官的一般构建过程分为肠道隐窝或干细胞的分离、原代肠道类器官的构建、肠道类器官的传代培养三个主要部分。不同物种、肠道组织来源的肠道类器官构建方法主要的区别在于培养基中细胞因子的成分差异。(详情请点击阅读原文)
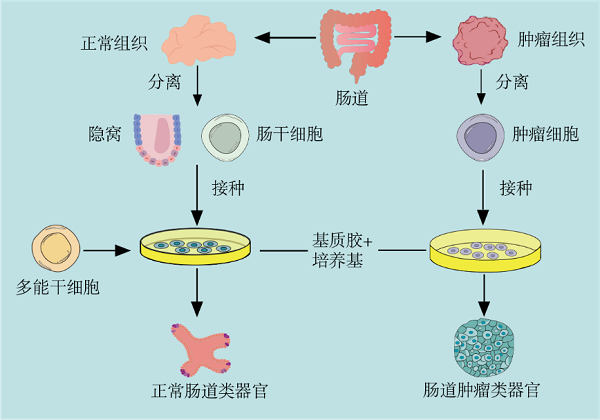
图2. 肠道类器官的构建过程(改编自[12])
肠道类器官的应用
直接由人体肠道分离的肠道隐窝或干细胞所衍生的肠道类器官,其生理结构、细胞组成以及遗传特性能够最大限度地模拟天然人体肠道组织。而且,不同患者来源的肠道类器官还能保留该患者自身的个体化组织特征。同时,肠道类器官具有更为良好的可操作性,可以更加精确地揭示肠道疾病机制。对于肠道疾病的不同诱导因素,如上皮屏障功能损伤、异常免疫应答、微生物群紊乱等,不仅可以进行单因素分析,也能够通过共培养、多组学等方式探究其内在联系。(详情请点击阅读原文)
展望
肠道类器官技术为肠道体外研究提供了前所未有的全新见解,为肠道疾病机制探索提供了一个全新且可靠的平台。尽管如此,肠道类器官仍然遇到了限制其发展的瓶颈。未来,肠道类器官的发展需要聚焦于以下几个方面(包括但不限于)。
其一,提升肠道类器官共培养体系的复杂性。目前所开发的肠道类器官主要为肠道上皮类器官,虽然能够有效模拟肠道上皮组织的生理结构,但是缺少肠道干细胞生态位中的其他组成部分,包括间充质细胞、成纤维细胞、免疫细胞,血管、神经组织和肠道菌群等。
其二,肠道类器官培养方式的开发。传统的肠道类器官培养方法主要是将类器官包埋在基质胶(Matrigel)中,而基质胶自身的生物力学特性会限制类器官的表型。悬滴培养、2D单层培养、类器官反极化等技术虽然已经问世,但仍需进一步推广应用。
另外,还有其他亟待解决的问题:如何加强肠道类器官培养过程中的工程控制,的以提高实验结果的重复性和一致性;如何防止肠道肿瘤类器官的异质性在长期培养过程中丢失;基于器官芯片的类器官芯片技术也是未来肠道类器官发展的重点方向之一[13]。
虽然肠道类器官的发展与运用还存在诸多挑战,但是其研究前景十分广阔。近年来,随着单细胞测序、空间转录组学、活细胞成像等新兴生物技术的快速发展,以及水凝胶等新兴生物材料的应用,基于肠道类器官的相关研究被推向了更深远更广阔的新维度。
参考文献
[1] 郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析. 中华肿瘤杂志, 2024, 46(3): 221-231
[2] Park G, Rim Y A, Sohn Y, et al. Replacing animal testing with stem cell-organoids: advantages and limitations. Stem Cell Rev Rep, 2024. DOI:10.1007/s12015-024-10723-5
[3] Sato T, Vries R G, Snippert H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 459(7244): 262-265
[4] Sailaja B S, He X C, Li L. The regulatory niche of intestinal stem cells. J Physiol, 2016, 594(17): 4827-4836
[5] Barreto e Barreto L, Rattes I C, da Costa A V, et al. Paneth cells and their multiple functions. Cell Biol Int, 2022, 46(5): 701-710
[6] Fre S, Huyghe M, Mourikis P, et al. Notch signals control the fate of immature progenitor cells in the intestine. Nature, 2005, 435(7044): 964-968
[7] Cordero J B, Sansom O J. Wnt signalling and its role in stem cell-driven intestinal regeneration and hyperplasia. Acta Physiol, 2012, 204(1): 137-143
[8] 谢文文, 刘振华, 张得香, 等. 表皮生长因子信号调控隐窝-绒毛轴更新和再生的研究进展. 动物营养学报, 2021, 33(7): 3726-3734
[9] Auclair B A, Benoit Y D, Rivard N, et al. Bone morphogenetic protein signaling is essential for terminal differentiation of the intestinal secretory cell lineage. Gastroenterology, 2007, 133(3): 887-896
[10] Cameron O, Neves J F, Gentleman E. Listen to your gut: key concepts for bioengineering advanced models of the intestine. Adv Sci: Weinh, 2024, 11(5): e2302165
[11] Taelman J, Diaz M, Guiu J. Human intestinal organoids: promise and challenge. Front Cell Dev Biol, 2022, 10: 854740
[12] 李精伟, 陈浩, 沙卫红, 等. 结直肠癌类器官的应用进展与挑战. 科技导报, 2022, 40(12): 28-41
[13] 施慧琳, 朱锋荣, 徐萍, 等. 2023年类器官领域发展态势. 生命科学, 2024, 36(1): 48-54
作者简介
强龙征:浙大宁波理工学院生物与化学工程学院本科生,研究方向:肠道发育与免疫。
毛海光:浙大宁波理工学院生物与化学工程学院助理研究员,研究方向:动物分子遗传学。
王进波:浙大宁波理工学院生物与化学工程学院教授,研究方向:微生物与粘膜免疫、基因工程药物。
(作者:强龙征、毛海光、王进波)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: