
心衰过程中非编码RNA的作用
心力衰竭(heart failure,HF)简称心衰,是指多种原因引起的心脏收缩和/或舒张功能降低而使心脏的泵血量不能满足人体代谢需要的一组临床综合征,是心梗、病理性或先天性心肌肥大、缺血性心脏病、高血压等心脏疾病发展的最后表现。心脏是机体的动力器官,主要功能是通过心肌的收缩推动血液将氧气和营养物质输送到身体各组织器官,经由体循环和肺循环完成机体各个组织与外界的物质交换过程。心衰时,心脏泵血功能异常,无法提供足够的血液。左心衰时,左心室收缩力降低,血液不能完全排出,会导致肺静脉高压而引起肺淤血使患者呼吸困难;右心衰时,右心室收缩乏力,血液无法泵入肺部,会导致体循环淤血,引起全身水肿,随着心衰的加重,机体供血更加不足,心肌代偿性肥厚以增强心肌收缩力,同时,神经系统会释放激素加快心率、增强心肌收缩力来进行调节以维持心脏的功能。

非编码RNA(non-coding RNA,ncRNA)是指不编码蛋白质的RNA,主要在表观遗传修饰、转录起始以及蛋白质翻译等过程中发挥调控作用。ncRNA在心脏疾病中扮演重要角色,研究表明,ncRNA可通过调节靶基因表达进而影响心肌细胞增殖与分化、心肌重塑、心肌肥大、心肌纤维化等相关蛋白质的表达,参与心脏生理病理进程[1-2]。研究者较为关注的ncRNA有:微RNA(microRNA, miRNA)、环状RNA(circRNA)以及长链非编码RNA(long non-coding RNA,lncRNA)。
miRNA是一种内源性的单链短RNA,大小约为22个核苷酸,主要通过结合信使RNA(messenger RNA,mRNA)的3'非编码区(3' untranslated region,3'UTR)调节靶基因表达[3]。miRNA可以调节多种心脏功能,包括心脏肌肉收缩、心脏发育和心脏形态等病理变化[4]。在心衰过程中,一些miRNA在心衰患者中过表达或缺失,促使心肌细胞损伤或凋亡,影响心脏功能,使心脏表现出心肌肥大和心肌纤维化,加快心衰进程。通过抑制或过表达miRNA调控靶基因进而改善心肌代谢、缓解心肌肥大,来保护心脏的结构和功能的完整性。例如,miR-24通过调节葡萄糖6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)表达,改善肥大心肌细胞线粒体功能,降低氧化应激[5]。
lncRNA是一种长度大于200个核苷酸的非编码RNA,其可通过调节基因转录、翻译及翻译后修饰、表观修饰、蛋白质或RNA稳定性等调控细胞周期、细胞分化、细胞代谢等多种生理病理过程[6]。lncRNA可以通过调控靶miRNA或蛋白质调控线粒体氧化应激,影响心衰进展。例如,lncRNA通过与SIRT2相互作用激活LKB1-AMPK信号通路维持心脏代谢稳态,改善心脏功能[7]。
circRNA是一种单链环状RNA,大部分circRNA是由前体mRNA的外显子区域、内含子区域、外显子-内含子区域或编码蛋白质的基因的转运RNA(tRNA)的内含子区域反向剪切形成,剪切后的RNA的3'端和5'端以磷酸二酯键相连,形成环形RNA[8]。circRNA主要通过作为miRNA的海绵来吸附并miRNA,从而发挥调控作用。研究证实,circRNA CDR1as是miR-135a和miR-135b的分子海绵,可抑制其表达,进而通过影响HMOX1表达调控心肌细胞凋亡[9]。
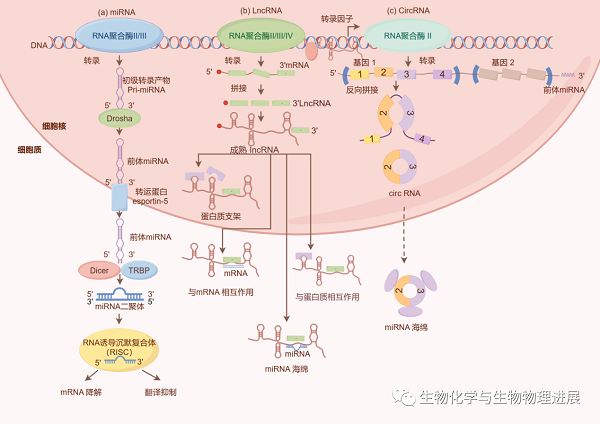
大量的研究结果证实,ncRNA在心血管疾病中扮演着重要的调控角色,能够调节线粒体结构和功能,并通过多个信号通路影响心肌细胞的生存、增殖和纤维化等过程(详情请点击阅读原文),从而对心脏发育、功能和病理过程产生影响。差异表达的miRNA、lncRNA和circRNA可能作为心血管疾病的生物标志物,对其生理调控机制的揭示可为心衰疾病的预测、诊断和治疗提供新的途径和靶点。可以期待在未来临床治疗中,通过纳米颗粒包装等新技术手段,利用RNA调控网络,将特定的ncRNA靶向注射到患者心脏中,实现早期干预治疗,延缓疾病进展甚至实现治愈。不过,关于ncRNA对其靶基因或靶蛋白的调控作用仍有待进一步阐明。
心力衰竭作为一种进展性疾病,需要长期管理和治疗。在日常生活中,心衰患者应少食多餐、少油少盐,限制液体摄入,缓解胃肠道压力,同时也要积极配合使用营养心肌、利尿等药物治疗,改善患者所出现的症状,延缓心衰进程。进行适度的有氧运动和抗阻运动可以有效改善心衰患者的心血管功能、肺脏功能和肌肉功能,提高运动能力和生活质量[10]。在开始运动前,要做好全面身体评估和准备,详细了解患者病史、用药情况、身体症状等,并开展恰当的身体评估,从而有针对性地制定合适的运动处方,注意根据患者运动喜好和习惯设计有氧运动、抗阻运动、柔韧性练习。起初最好在专业人员的指导下进行,实时监测运动情况,及时调整训练方案。详细内容可参见《慢性心力衰竭心脏康复中国专家共识(2020)》[11]、慢性心衰患者运动指南[12]。
参考文献
[1] Fasolo F, Di Gregoli K, Maegdefessel L, et al. Non-coding RNAs in cardiovascular cell biology and atherosclerosis. Cardiovasc Res, 2019, 115(12): 1732-1756
[2] Poller W, Dimmeler S, Heymans S, et al. Non-coding RNAs in cardiovascular diseases: diagnostic and therapeutic perspectives. Eur Heart J, 2018, 39(29):2704-2716
[3] Catalucci D, Gallo P, Condorelli G. MicroRNAs in cardiovascular biology and heart disease. Circ Cardiovasc Genet, 2009, 2(4):402-408
[4] Kalayinia S, Arjmand F, Maleki M, et al. MicroRNAs: roles in cardiovascular development and disease. Cardiovasc Pathol, 2021, 50: 107296
[5] Li B, Wang X, Yu M, et al. G6PD, bond by miR-24, regulates mitochondrial dysfunction and oxidative stress in phenylephrineinduced hypertrophic cardiomyocytes. Life Sci, 2020, 260: 118378
[6] Bridges M C, Daulagala A C, Kourtidis A. LNCcation: lncRNA localization and function. J Cell Biol, 2021, 220(2): e202009045
[7] Kim S, Song J, Ernst P, et al. MitoQ regulates redox-related noncoding RNAs to preserve mitochondrial network integrity in pressure-overload heart failure. Am J Physiol Heart Circ Physiol,2020, 318(3): H682-H695
[8] Lu P, Ding F, Xiang Y K, et al. Noncoding RNAs in cardiac hypertrophy and heart failure. Cells, 2022, 11(5): 777
[9] Chen C, Shen H, Huang Q, et al. The circular RNA CDR1as regulates the proliferation and apoptosis of human cardiomyocytes through the miR-135a/HMOX1 and miR-135b/HMOX1 axes. Genet Test Mol Bioma, 2020, 24(9): 537-548
[10] 刘德平. 心力衰竭患者如何运动--2020ESC心血管疾病患者运动心脏病学和体育锻炼指南解读. 中国心血管杂志, 2021, 26(1): 5-7
[11] 中国康复医学会心血管病预防与康复专业委员会. 慢性心力衰竭心脏康复中国专家共识. 中华内科杂志, 2020, 59 (12): 942-952
[12] Taylor J L, Myers J, Bonikowske A R. Practical guidelines for exercise prescription in patients with chronic heart failure. Heart Fail Rev, 2023, 28(6): 1285-1296
作者简介
吕佳霖:天津体育学院运动人体科学专业硕士研究生,研究方向为运动干预慢性疾病的线粒体机制。
(作者:吕佳霖)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: