
Nanoluc帮你"沙里淘金"--PROTAC库的筛选
生物发光领域的新宠:Nanoluc
自古代文明开始以来,生物发光现象一直吸引着科学家和普通民众的兴趣。生物发光是一种在某些生物体中发生的化学反应,从而产生可见光。在自然界中,生物发光的原因多种多样,包括种间交流、狩猎、定位食物、吸引猎物和自卫等。

深海中水母的生物发光现象(图片来自pixabay)
虽然人们对生物发光的观察可以追溯到数千年前,但直到上个世纪,随着分子生物学的进步,科学家们研究生物发光的潜在机制才成为可能。现在,我们已经普遍知道生物发光是一种化学过程,其产生光的能力依赖于酶和底物之间的相互作用。这种反应过程所需的酶被称为荧光素酶,而底物的类型则因荧光素酶的不同而有所差异[1]。
虽然已有几种荧光素酶及其相应底物被研究人员使用了十多年,但一些新型荧光素酶直到前几年才投入市场。Nanoluc技术是一种新型的生物发光分析技术,它是一个经过基因工程改造的生物发光报告基因。Nanoluc的蛋白质产物(Nanoluc®荧光素酶)能够与新型底物furimazine作用,催化其氧化反应,释放能量,产生高强度、辉光型发光信号。这种新型酶的出现开辟了更广阔的应用前景。
Nanoluc®荧光素酶的体积非常小(19.1kDa,171个氨基酸),这使得Nanoluc在标记细胞和蛋白质时,对样本的侵入性更小,有助于保持细胞或组织的天然状态。在保证标记的同时,Nanoluc具有极高的光强度,其光信号非常明亮。这使得Nanoluc在低浓度样本中的检测更为敏感,有助于检测低表达的目标物质,提高了分析的灵敏度[2-3]。除此之外,Nanoluc技术还具有快速反应、低背景发光和多样灵活等特点,这种由Promega公司开发的新型生物发光技术在生物学和医学研究中有着广泛的应用前景。
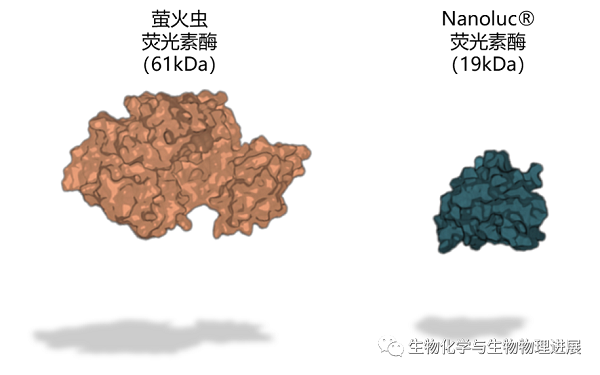
Nanoluc®荧光素酶与萤火虫荧光素酶比较
PROTAC的兴起
靶向蛋白质降解嵌合体(PROTAC)是人工构建的一个小分子复合物工具,它一端是结合泛素连接酶的配体,另一端是让细胞内目的蛋白(POI)结合的配体,中间通过连接链(Linker)连接[4]。PROTAC能够诱导目的蛋白被泛素化标记,后经泛素-蛋白酶体途径降解。该技术利用细胞自身的降解机制使致病蛋白质发生降解,可作为癌症、自身免疫疾病和神经系统疾病等的一种新型治疗方法,拥有巨大的应用前景[5-10]。与传统小分子药物不同的是,PROTAC药物不需要与致病靶点紧密、长时间结合,具有降解"不可成药"靶点的优势。此外,PROTAC这一技术具有底物选择性、组织特异性和克服耐药性等一系列优点,受到了学术界和工业界的广泛关注[11-13]。
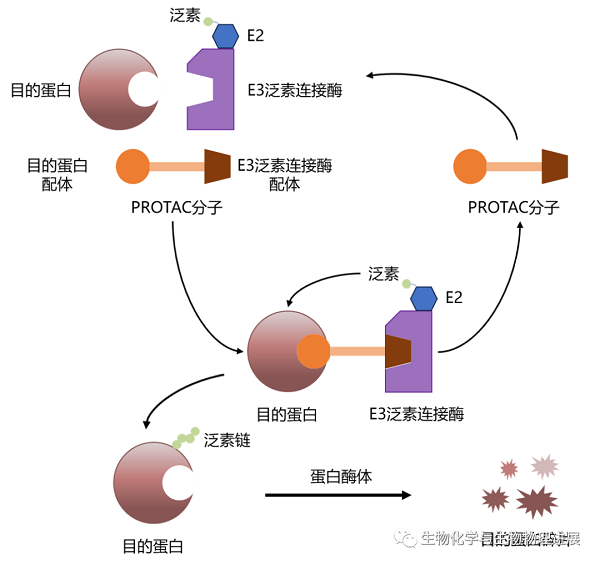
PROTAC机制示意图
目前,PROTAC的反复迭代与优化主要基于经验,而针对新靶点的PROTAC开发往往依赖于大量的化合物合成和高通量筛选策略。然而,检验PROTAC效应的金标准是蛋白质免疫印迹(Western blot)技术,该方法耗时费力且难以应用于大容量化合物库的筛选过程。因此,实现稳定且高通量的筛选策略对于PROTAC的成功开发是必不可少的条件。
子承父业--NanoBiT技术
Nanoluc的衍生技术NanoBiT是一种双荧光素酶互补体技术,专用于研究蛋白质相互作用。该技术由Promega公司的研究科学家利用定向进化技术开发而成,由两个亚基组成,分别是大BiT (LgBiT,18kDa) 和小BiT (SmBiT,11氨基酸肽),它们可作为融合蛋白与2个待测目的蛋白相互表达。这两个亚单位本身不具备荧光活性,但当它们结合在一起时,形成一个完整且高度活性的荧光酶。换言之,目的蛋白之间的相互作用促使这两个亚基结合,从而激活荧光素酶的活性,进而与底物反应产生明亮的发光信号。
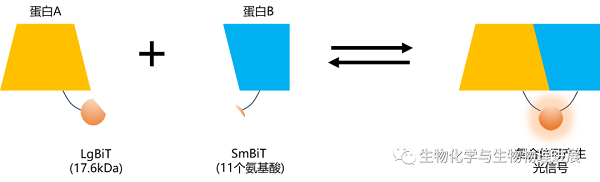
NanoBiT机制示意图
科学家在对SmBiT研究过程中,发现不同序列的肽段对于LgBiT的亲和力存在差别。与LgBiT具有极强亲和作用的肽段,被命名为HiBiT(11个氨基酸的小亚基)。HiBiT标签可以方便构建到目的蛋白的N端、C端或者中间的任何位置。如果将融合HiBiT标签的靶蛋白与LgBiT共表达,由于HiBiT与LgBiT具有很强的亲和力,可自发互补结合,形成具有催化活性的Nanoluc®荧光素酶,在底物存在的情况下,可产生明亮的发光信号。发光信号强度与HiBiT标签结合蛋白在细胞中的含量成正比,线性范围超过7个数量级,在数小时内均可产生稳定的辉光型信号[14-15]。设想,如果在产生发光信号的细胞中加入靶蛋白的PROTAC,就可以诱导靶蛋白的降解,并利用荧光素酶系统检测到化学发光信号的降低。
基于Nanoluc技术和荧光分析技术的筛选体系
基于以上设想,我们拟建立一个利用Nanoluc®荧光素酶的PROTAC筛选平台。但由于Nanoluc®荧光素酶的活性依赖于HiBiT融合蛋白与LgBiT的组装效率,如果采用瞬时转染的方法,质粒的质量、转染条件(转染比例和转染试剂)、实验批次都会影响细胞内Nanoluc®荧光素酶的活性,进而对筛选平台的建立及后续的筛选产生很大的影响。
为了建立更为稳定可靠的基于HiBiT标签的高通量蛋白质降解筛选技术,我们将LgBiT融合绿色荧光蛋白GFP,将HiBiT融合红色荧光蛋白mCherry和Target,然后构建了稳定过表达的细胞系,建立了一种联合Nanoluc生物发光和荧光分析的降解剂筛选平台。通过观测GFP与mCherry的共定位情况,可以直观评价Nanoluc®荧光素酶的组装情况,后期还可通过流式细胞术评价PROTAC诱导底物降解的效率。
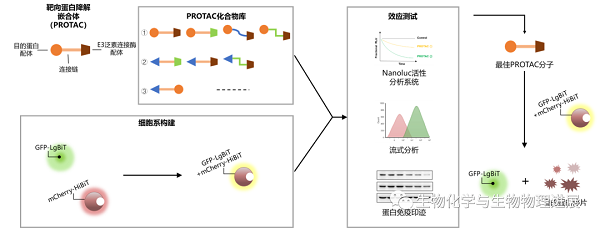
筛选体系示意图
后期通过免疫印迹技术对筛选出的PROTAC进一步验证,可得到较为理想的PROTAC分子。有关"基于Nanoluc技术和荧光分析技术建立蛋白质水解靶向嵌合体筛选方法及评价"请点击阅读原文。
参考文献
[1] England C G, Ehlerding E B, Cai W. NanoLuc: a small luciferase is brightening up the field of bioluminescence. Bioconjug Chem, 2016, 27(5): 1175-1187
[2] Hall M P, Unch J, Binkowski B F, et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem Biol, 2012, 7(11): 1848-1857
[3] Liu X, Zhang X, Lv D, et al. Assays and technologies for developing proteolysis targeting chimera degraders. Future Med Chem, 2020, 12(12): 1155-1179
[4] Garber, K. The PROTAC gold rush. Nat Biotechnol, 2022, 40: 12-16
[5] Lai A C, Crews C M. Induced protein degradation: an emerging drug discovery paradigm. Nat Rev Drug Discovery, 2017, 16(2): 101-114
[6] Cromm P M, Crews C M. Targeted protein degradation: from chemical biology to drug discovery. Cell Chem Biol, 2017, 24(9): 1181-1190
[7] Bekes M, Langley D R, Crews C M. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discovery, 2022, 21(3): 181-200
[8] Cao C, He M, Wang L, et al. Chemistries of bifunctional PROTAC degraders. Chem Soc Rev, 2022, 51(16): 7066-7114
[9] He M, Cao C, Ni Z, et al. PROTACs: great opportunities for academia and industry (an update from 2020 to 2021). Signal Transduction Targeted Ther, 2022, 7(1): 181
[10] Sun X, Gao H, Yang Y, et al. PROTACs: great opportunities for academia and industry. Signal Transduction Targeted Ther, 2019,4: 64
[11] Samarasinghe K T G, Crews C M. Targeted protein degradation: a promise for undruggable proteins. Cell Chem Biol, 2021, 28(7): 934-951
[12] Pettersson M, Crews C M. Proteolysis targeting chimeras (PROTACs) - past, present and future. Drug Discovery Today Technol, 2019, 31: 15-27
[13] Zeng S, Huang W, Zheng X, et al. Proteolysis targeting chimera (PROTAC) in drug discovery paradigm: recent progress and future challenges. Eur J Med Chem, 2021, 210: 112981
[14] Riching K M, Mahan S, Corona C R, et al. Quantitative live-cell kinetic degradation and mechanistic profiling of PROTAC mode of action. ACS Chem Biol, 2018, 13(9): 2758-2770
[15] Schwinn M K, Machleidt T, Zimmerman K, et al. CRISPRmediated tagging of endogenous proteins with a luminescent peptide. ACS Chem Biol, 2018, 13(2): 467-474
作者简介
刘明秋:安徽医科大学基础医学院细胞生物学硕士,研究方向为利用PROTAC技术靶向降解蛋白质促进骨形成的策略研究。
(作者:刘明秋)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: