
SUMO化修饰:哺乳动物胚胎发育的重要调控者
战国时期著名思想家庄周在《知北游》中以“人生天地之间,若白驹过隙,忽然而已”,寓意人生于天地之间,就像骏马穿过一个狭窄的通道,瞬间而过罢了,慨叹生命的短暂与可贵。“天地之大德曰生”,生命是自然界永恒不变的话题,自然界乃至宇宙中的一切事物正是因为有了生命的存在才具有了特殊的价值和意义。

图片由Jill Sauve在Unsplash上发布
在哺乳动物中,新生命的开始是在受精时触发的[1]。受精卵经过几轮有丝分裂,形成胚泡,这一过程主要分为三个部分:①受精和第一次细胞分裂;②持续细胞分裂;③建立细胞极性并经历桑葚胚压实,分化成胚泡[1]。胚胎发育是一个复杂的过程,这一过程依赖于基因表达网络的精细协调。
而本文的主角——小分子泛素相关修饰物(small ubiquitin-related modifier,SUMO),已被证明在调控这一基因表达网络中扮演着重要角色,在多种物种的早期胚胎发育中发挥着重要作用。据报道,全世界有15%左右的育龄夫妇正在遭受不育症的困扰[1],总人数已经超过1.86亿,其中绝大多数患者来自发展中国家。在那些不孕不育的案例中,其中50%以上是由于女性不育导致的。造成女性不育的3个主要因素为:胚胎着床失败、子宫不能进入接受态、蜕膜化失败[2]。而在这3个因素中,胚胎发育异常造成胚胎着床失败是导致早期妊娠失败最主要的原因(图1)。SUMO化修饰在协调囊胚和子宫之间的对话、心脏的发育和颅面的发育中发挥着重要作用。当SUMO化修饰出现异常时,可能导致胚胎植入前缺陷、胚胎发育缺陷以及胚胎致死。
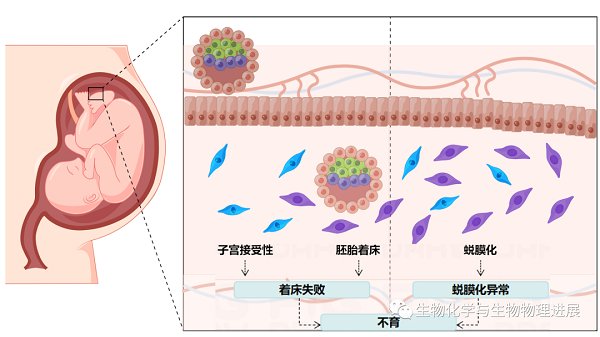
图1 子宫接受态、着床和/或蜕膜化异常可导致妊娠失败(由Figdraw绘制,ID:WOPISc373)
SUMO家族概况
SUMO蛋白的大小约为10 ku,有类似于泛素的三维结构。作为可逆的蛋白质翻译后修饰的一种重要修饰形式,SUMO化在蛋白质的活性、定位和稳定性方面发挥着重要作用。已知在人类基因组中主要编码4种亚型的SUMO蛋白,分别是SUMO1、SUMO2、SUMO3和SUMO4。在氨基酸水平上,SUMO2与SUMO3具有97%的同源性(通常简称为SUMO2/3),而其与SUMO1只有46%的同源性。SUMO4主要在肾脏、脾脏组织和淋巴结等免疫组织中表达,尽管SUMO4的功能尚不清楚,但有研究发现SUMO4与1型糖尿病的易感性具有相关性[3]。
SUMO化的分子机制
SUMO化是一个动态可逆的过程(图2),主要发生在底物的蛋白质结合保守序列(Ψ-K-X-[D/E])上,其中Ψ是任何大的疏水残基(如亮氨酸、异亮氨酸或缬氨酸),K是目标赖氨酸,X可以是任意氨基酸,D/E是天冬氨酸/谷氨酸。SUMO前体在泛素样蛋白加工酶(ULPs)或SUMO特异性蛋白酶(SENPs)的加工下产生SUMO-GG,由SUMO E1酶(Aos1-Uba2)激活,转移到SUMO E2酶(Ubc9),并通过SUMO E3连接酶(PIAS)与底物结合,最后,修饰底物可通过ULP/SENP发生去SUMO化,使蛋白质的SUMO化和去SUMO化之间处于微妙的平衡状态。
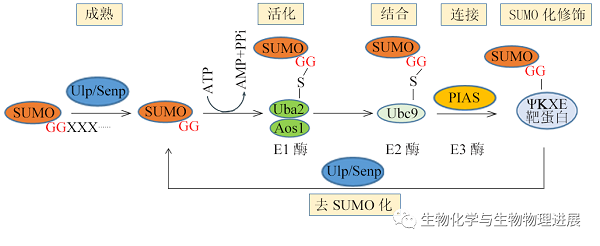
图2可逆的SUMO化机制
SUMO化在胚胎发育中的功能
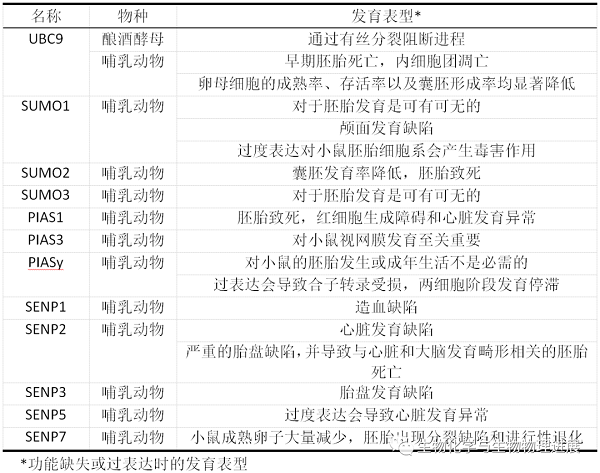
SUMO途径的组成成分(包括SUMO蛋白、E2酶、E3酶和SENPs)在哺乳动物早期胚胎发育以及随后的器官发生过程中起着关键作用(表1)。
1.SUMO蛋白
除了组织特异性表达的SUMO4外,哺乳动物体内主要表达3种SUMO蛋白(SUMO1~3)。在小鼠的整个胚胎发育过程中,SUMO1~3都存在广泛的表达,但SUMO1似乎并不是胚胎发育的关键决定因素,因为SUMO1基因敲除小鼠是可以存活的,并且没有任何明显的表型。Wang等[4]通过分别构建SUMO2和SUMO3基因敲除小鼠,证明了SUMO2的缺失会导致胚胎致死,而SUMO3则无明显表型。与上述结果相反,Alkuraya等[5]通过对SUMO1基因陷阱突变(RRQ016)小鼠进行研究,发现杂合子胚胎发育会产生颅面缺陷,表明SUMO1在小鼠颅面发育中具有重要作用。
2.E2酶(Ubc9)
UBC9作为SUMO修饰途径中由单个基因编码的蛋白质,它是唯一的SUMO E2酶,它的缺失会完全消除SUMO化。在小鼠胚胎发育中,UBC9功能缺失的小鼠胚胎在染色体分离中显示出严重缺陷,并导致植入后早期胚胎死亡以及胚泡内细胞团细胞的选择性凋亡[6]。
3.E3连接酶(PIAS)
在哺乳动物中PIAS家族包括5种亚型,分别为PIAS1、PIAS3、PIASxα、PIASxβ和PIASy。Constanzo等[7]报道了大约90%的PIAS1缺失胚胎在E10.5和E12.5之间死亡,并且卵黄囊的红细胞生成和血管生成存在缺陷。此外,由于心肌质量的损伤还会损害胎儿发育过程中的心脏发育。
PIAS3在小鼠视网膜发育中具有独特的表达模式。在体视网膜发育过程中PIAS3的过度表达会促进视杆的分化并抑制视锥特异基因的表达[8]。此外,作者发现PIAS3在视锥细胞中也起作用,通过调节视锥视蛋白基因不同亚型的正确表达来保证色觉发育正常。
Wong等[9]和Roth等[10]分别研究了PIASy敲除小鼠的特征,发现PIASy对小鼠的胚胎发生或成年生活不是必需的,胚胎没有明显的表型异常,表明存在其他PIAS蛋白的补偿作用。然而,受精卵中PIASy的过表达会导致严重的异常染色体分离和合子转录受损,在两细胞阶段引起发育停滞。
4.SENPs
人类中已经鉴定出6个SENP成员:SENP1、SENP2、SENP3、SENP5、SENP6和SENP7。迄今为止所报道的SENP基因敲除小鼠的胚胎都不能存活至出生,这表明SENPs没有冗余作用,具有特定的底物特异性。Yamaguchi等[11]通过在小鼠SENP1(SuPr-2)基因中插入逆转录病毒使得其表达降低,发现SUMO1的SUMO化水平显著提高,而SUMO2/3与靶蛋白结合水平无明显变化,表明SENP1对SUMO1具有特异性。此外,还有报道SENP1功能完全失活的转基因小鼠由于缺氧诱导因子1α(HIF1α)的稳定性失调而发生造血缺陷[12]。无独有偶,Caniggia等[13]研究发现,SENP3通过调控SUMO2/3的SUMO化水平来调节HIF1α的稳定性,在人类胎盘发育中具有重要作用,从而确保了胎儿的正常生长。
Yu等[14]研究发现,SENP2介导的胎盘形成需要SUMO2/3的存在,其缺失会造成严重的胎盘缺陷,并导致与心脏和大脑发育畸形相关的胚胎死亡。而最近的一项研究结果显示,SENP5在心脏结构的发育中也起着至关重要的作用[15]。作者研究发现,当妊娠母鼠处于缺锌状态时,会促使胚胎过度表达SENP5,从而导致心脏发育异常[15]。
此外,Huang等[16]研究发现,敲除SENP7基因会导致小鼠成熟卵子大量减少,并且胚胎出现分裂缺陷和进行性退化,从而确定了SENP7是胚胎发育程序的新决定因素。而SENP6在哺乳动物胚胎发育中的作用还未见详细报道,有待进一步研究。
表1 SUMO通路的各组成成分在发育中的作用
展望
SUMO化是调节多种发育调节因子活性的一种非常有效的策略,这在对胚胎的相关研究中已经得到证实。在所有已知的影响细胞发育的机制中都有SUMO化的身影,包括转录调控、蛋白质稳定性或蛋白质在细胞中的穿梭。SUMO化过程受微环境和很多因素的诱导,主要功能为诱导胚胎发育。总之,SUMO化对于了解正常的发育过程以及病理过程具有重要的意义,为研究防治一些生殖疾病提供新的思路和方法,未来值得进一步深入研究。(详情请点击阅读原文)
参考文献
[1] Wang H, Dey S K. Roadmap to embryo implantation: clues from mouse models. Nat Rev Genet, 2006, 7(3): 185-99
[2] Cha J, Sun X, Dey S K. Mechanisms of implantation: strategies for successful pregnancy. Nat Med, 2012, 18(12): 1754-67
[3] Song G G, Choi S J, Ji J D, et al. Association between the SUMO4 M55V (A163G) polymorphism and susceptibility to type 1 diabetes: a meta-analysis. Hum Immunol, 2012, 73(10): 1055-1059
[4] Wang L, Wansleeben C, Zhao S, et al. SUMO2 is essential while SUMO3 is dispensable for mouse embryonic development. EMBO Rep, 2014, 15(8): 878-885
[5] Alkuraya F S, Saadi I, Lund J J, et al. SUMO1 haploinsufficiency leads to cleft lip and palate. Science, 2006, 313(5794): 1751
[6] Nacerddine K, Lehembre F, Bhaumik M, et al. The SUMO pathway is essential for nuclear integrity and chromosome segregation in mice. Dev Cell, 2005, 9(6): 769-779
[7] Constanzo J D, Deng M, Rindhe S, et al. Pias1 is essential for erythroid and vascular development in the mouse embryo. Dev Biol, 2016, 415(1): 98-110
[8] Onishi A, Peng G H, Hsu C, et al. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron, 2009, 61(2): 234-246
[9] Wong K A, Kim R, Christofk H, et al. Protein inhibitor of activated STAT Y (PIASy) and a splice variant lacking exon 6 enhance sumoylation but are not essential for embryogenesis and adult life. Mol Cell Biol, 2004, 24(12): 5577-5586
[10] Roth W, Sustmann C, Kieslinger M, et al. PIASy-deficient mice display modest defects in IFN and Wnt signaling. J Immunol, 2004, 173(10): 6189-6196
[11] Yamaguchi T, Sharma P, Athanasiou M, et al. Mutation of SENP1/SuPr-2 reveals an essential role for desumoylation in mouse development. Mol Cell Biol, 2005, 25(12): 5171-5182
[12] Cheng J, Kang X, Zhang S, et al. SUMO-specific protease 1 is essential for stabilization of HIF1alpha during hypoxia. Cell, 2007, 131(3): 584-595
[13] Bhattacharjee J, Alahari S, Sallais J, et al. Dynamic regulation of HIF1Alpha stability by SUMO2/3 and SENP3 in the human placenta. Placenta, 2016, 40: 8-17
[14] Yu H I, Hsu T, Maruyama E O, et al. The requirement of SUMO2/3 for SENP2 mediated extraembryonic and embryonic development. Dev Dyn, 2020, 249(2): 237-244
[15] Zhang X, Wang C, Zhao D, et al. Zinc deficiency induces abnormal development of the myocardium by promoting SENP5 overexpression. PLoS One, 2020, 15(11): e0242606
[16] Huang C J, Wu D, Jiao X F, et al. Maternal SENP7 programs meiosis architecture and embryo survival in mouse. Biochim Biophys Acta Mol Cell Res, 2017, 1864(7): 1195-1206
作者简介
徐瑞:合肥综合性国家科学中心人工智能研究院实验动物平台基因编辑分子操作工程师,主要从事啮齿类实验动物基因修饰,利用基因编辑技术构建基因修饰小鼠模型,研究解析脑科学机理,应用于脑疾病治疗研究。研究方向为基因修饰小鼠在胚胎着床、蜕膜化过程中的表型及机制探讨。
王可:安徽医科大学细胞生物学专业硕士,现任职于安徽省第二人民医院生殖医学中心实验室。主要从事精液活力检测及少、弱精标本判断检验,精子形态和碎片全面分析以及对阴道微生态样本的全面检测。
张进京:合肥工业大学食品与生物工程学院博士研究生,合肥综合性国家科学中心人工智能研究院实验动物平台副主任。
张秀红:博士,安徽医科大学生命科学学院副教授。研究方向为利用小鼠模型结合人类临床标本和多种新兴研究方法,研究早期胚胎发育子宫接受态建立和蜕膜化的分子调控网络。通过揭示妊娠建立和维持的分子机理,为预防和治疗相关的生殖疾病提供参考和借鉴。
(作者:徐瑞、王可、张进京、张秀红)
(本文来源于公众号: 生物化学与生物物理进展)
附件下载: