
无中生有
想必大家都知道,蛋白质是构成生命体的基本成分,那么如此重要的生物大分子若没有完整的细胞,蛋白质会表达成功吗?今天,我们就一起来了解下"无细胞"蛋白质合成系统。
什么是"无细胞"蛋白质合成系统
无细胞蛋白质合成(cell-free protein synthesis,CFPS)系统是一种快速而且能高通量表达目标蛋白质的技术,是以外源DNA或mRNA为模板,在细胞裂解液提供多种酶的作用下通过补充底物和能量物质来实现蛋白质的体外合成【1-2】。目前CFPS系统主要有大肠杆菌裂解液、兔网织红细胞裂解液、小麦胚芽提取物、酵母提取物4种体系。
大肠杆菌裂解液是一种比较完善的原核CFPS系统,可以实现蛋白质的高通量表达,但在功能性蛋白质的翻译后修饰方面有一定的局限性。兔网织红细胞裂解液是基于哺乳动物系统研发的真核蛋白质合成平台,需要额外补充微球菌核酸酶才能实现功能性蛋白质的表达。小麦胚芽提取物是较完善的真核系统,适合于高通量复杂蛋白质的合成,但是制备成本高使其大规模合成受到限制。酵母提取物可以实现蛋白质的翻译后修饰,而且制备过程简单,但是产量低。目前研究者们大多还是采用大肠杆菌裂解液尤其是PURE(protein synthesis using recombinant elements)系统来实现蛋白质的合成。(各系统详细介绍及优缺点对比请点击阅读原文)
体内蛋白质合成 VS."无细胞"蛋白质合成
大家一定很好奇,既然细胞内可以合成目标蛋白,那为啥还要大费周章的开发无细胞体系来打破传统方法呢?正如图1所示,其实细胞内合成蛋白质的步骤十分繁琐,而且有些蛋白质(如毒性蛋白)在细胞内难以表达等,所以伟大的科学家们就开发了CFPS系统,能够在短时间内实现蛋白质的高通量表达。
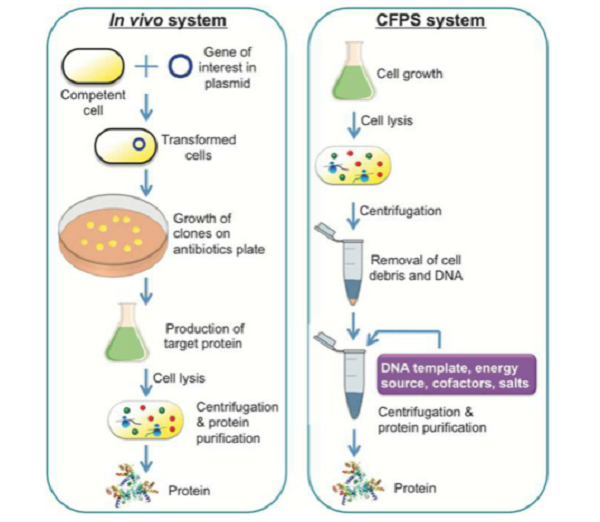
图1. 细胞与无细胞蛋白质合成系统的比较【3】
什么是人造细胞?
人造细胞是以分子为基元自下而上构建的具有部分(或全部)细胞功能的类细胞结构。该结构可揭示细胞内部的运行机制,帮助人们理解重大疾病的发病机理,并为生命起源提供线索。从构建基元角度,可以将其分为磷脂囊泡类细胞结构、聚合物囊泡类细胞结构、蛋白质体类细胞结构、液滴和凝胶类细胞结构等。

巨 型 磷 脂 囊 泡(giant unilamellar vesicle,GUV)是由两亲性的磷脂分子自组装形成尺寸大于1 μm、内外都是水相的泡状结构。GUV的结构与膜组分接近真实细胞,可以更好地模拟真实细胞。两亲性的嵌段聚合物分子在水溶性溶液中能够发生一定程度的聚集,形成胶束或囊泡结构,其中聚合物囊泡具有类细胞结构,而且比磷脂囊泡更稳定。蛋白质体(蛋白质囊泡)是由肽段或蛋白质分子在液滴或脂质体表面通过自组装形成的有膜类细胞结构,它具有真实细胞的某些特性如包封作用、膜的选择透过性等。微液滴是指两种不相容的溶液(混有表面活性剂)通过机械搅拌、超声或涡旋等方法制备的油包水/水包油乳液,细胞大小的封闭腔室、良好的生物相容性和较好的包封率使其也可作为人造细胞模型。微凝胶大多是采用DNA链或纳米黏土作为交联剂形成交联网状的类细胞结构,能够为蛋白质合成提供一个高通量表达、可循环使用的腔室微环境。除了以上几种人造细胞,还有凝聚体类细胞结构、胶体囊泡类细胞结构以及纳米微球等。各类人造细胞都具有各自不同的特点,应根据实验需求选择合适的实验方案。构建含有CFPS系统的人造细胞不仅可以帮助人们了解细胞的运行机制,还具有作为生物工厂的工业化应用前景。
人造细胞内CSPF系统的运用
利用CFPS系统在人造细胞内表达合成蛋白质,这种有限的空间不仅会使蛋白质的表达量有所提高,还可以更好地模拟真实细胞的结构与功能。磷脂囊泡类细胞结构因其组分与结构接近于真实细胞,蛋白质合成的相关研究较多。聚合物囊泡、蛋白质囊泡的稳定性较好,微凝胶的蛋白质合成产量较高。
图2. 人造细胞内利用CFPS系统表达蛋白质示意图
近30年来,该领域取得了长足发展。目前人造细胞已经能够模拟细胞的代谢【4】、生长【5】、分裂【6】等功能。持续供能的代谢模拟、天然磷脂合成参与的繁殖等细胞功能的模拟是本领域的巨大挑战。人造细胞内蛋白质的表达对于解决上述挑战具有重要意义。
参考文献:
【1】Yue K, Trung T N, Zhu Y Y, et al.C o-translational insertion of aquaporins into liposome for functional analysisVia an E. coli based cell-free protein synthesis system. Cells, 2019,8(11): 1325
【2】Levine M Z, Gregorio N E, Jewett M C, et al. Escherichia coil-based cell-free protein synthesis: protocols for arobust, flexible, and accessible platform technology. Jove-Journal of VisualizedExperiments, 2019, 144,doi:10.3791/58882
【3】Khambhati K, Bhattacharjee G, Gohil N, et al. Exploring the potential of cell-freeprotein synthesis for extending the abilities of biological systems. Frontiersin Bioengineering and Biotechnology, 2019, 7: 16
【4】Buddingh B C, van Hest J C M. Artificial cells: synthetic compartments with life-like functionality and adaptivity. Accounts of ChemicalResearch, 2017, 50(4): 769-777
【5】Hanczyc M M, Fujikawa S M, Szostak J W.Experimental models of primitive cellular compartments: encapsulation, growth,and division. Science, 2003, 302(5645): 618-622
【6】Miele Y, Medveczky Z, Holl G, et al. Self-division of giant vesicles drivenby an internal enzymatic reaction. Chemical Science, 2020, 11(12): 3228-3235
作者简介:
韩晓军:哈尔滨工业大学教授、博士生导师、英国皇家化学会会士(FRSC)、教育部高等学校化工类专业教学指导委员会委员。入选新世纪优秀人才支持计划,获批黑龙江省杰出青年科学基金。主要从事生物体系自组装、人造细胞(Artificial Cells)、纳米生物技术等领域研究。
赵晶晶:哈尔滨工业大学博士研究生,专业为化学工程与技术。现阶段主要从事人造细胞的相关研究。
(作者:韩晓军、赵晶晶)
(本文来源于公众号: 生物化学与生物物理进展)
附件下载: